Die brownsche Molekularbewegung begegnet uns immer wieder in unserem Alltag, aber in welcher Form, Art und Weise?
Damit, und vielen weiteren Erklärungen, sowie einem anschaulichen Beispiel befasst sich dieser Artikel.
Hat dies dein Interesse geweckt? Dann schnupper doch gerne einmal herein.
Die brownsche Molekularbewegung wurde im Jahr 1827, von Robert Braun, entdeckt.
Dieser stellte fest, dass sich in scheinbar stillem Wasser aufgelöste Gräserpollen unregelmäßig und zickzack-artig umherbewegen.
Definition
Unregelmäßige zickzack-artige Bewegung kleiner Teilchen in Flüssigkeiten
und Gasen.
Bei der brownschen Molekularbewegung stoßen größere Teilchen mit anderen Teilchen der Umgebung zusammen, welche so klein sind dass man sie mit dem bloßen Auge gar nicht erkennen kann.
Trotzdem können diese die größeren Teilchen durch viele unregelmäßige Stöße in Bewegung setzen, was zu zufälligen Bewegungen der größeren Teilchen führt.
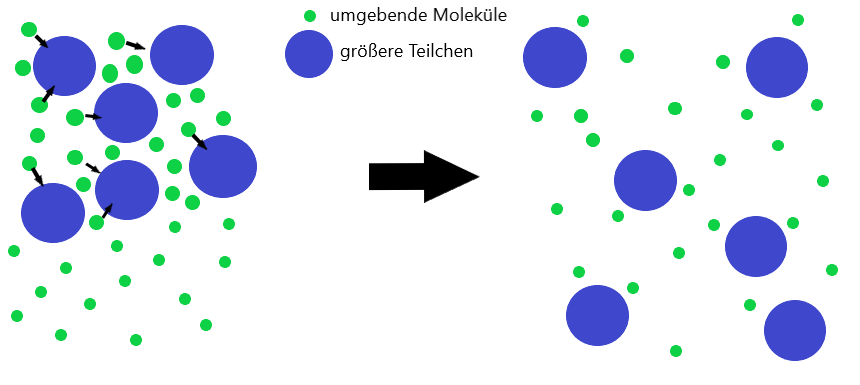
Die größeren, in Bewegung versetzten, Teilchen können dabei um den Faktor 10.000 bis 100.000 größer sein als die anderen, sie umgebenden, Moleküle.
Größe der Teilchen in Relation
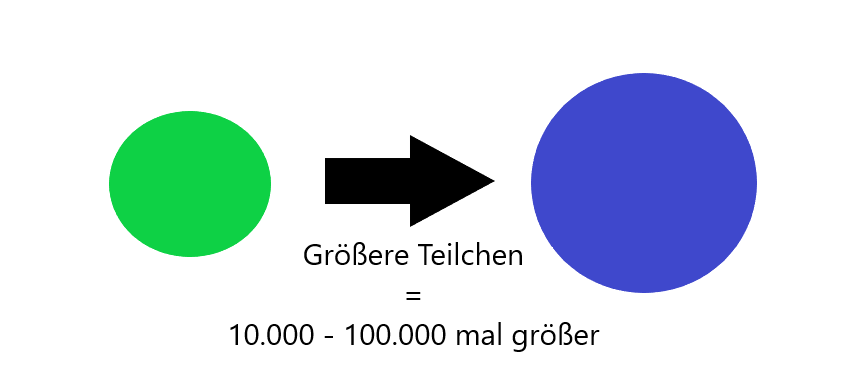
Hier ist das Ganze nocheinmal bildlich dargestellt.
Bitte beachte allerdings, dass die Relation nicht genau dargestellt werden konnte und es nur zu Veranschaulichung dient.
Brownsche Molekularbewegung Temperatur und Diffusion
Grundsätzlich lässt sich sagen, je höher die Temperatur eines Stoffes, desto schneller bewegen sich die darin enthaltenen Teilchen.
Daher kann man auch sagen, dass die brownsche Molekularbewegung gleich zur Temperatur ist, denn die Temperatur eines Stoffes ist gleichgesetzt zur Geschwindigkeit der darin enthaltenen Teilchen.
Auch gibt es hier die Diffusion, welche allerdings die allgemeine Bewegung von Teilchen beschreibt, die sich von einem Ort mit höherer Teilchenkonzentration zu einem Ort mit niedrigerer Teilchenkonzentration bewegen.
Diffusion
Die Diffusion ist ein Prozess, bei dem sich Stoff von einem Ort der höheren Konzentration zu einem Ort mit niedrigerer Konzentration bewegen, um einen Konzentrationsausgleich zu schaffen.
Hier siehst du ein Beispiel von Diffusion:
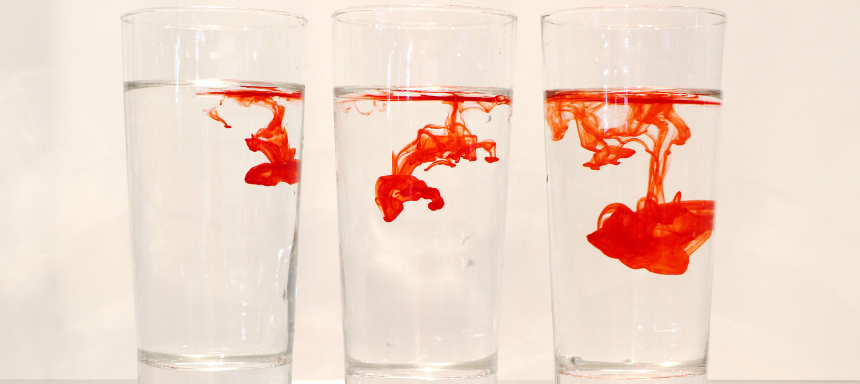
Die Verbreitung von Farbe im Wasser, um für einen Konzentrationsausgleich zu sorgen.
Unterschied Diffusion und Motilität
Während sich bei der Diffusion die Teilchen, durch die Zusammenstöße mit anderen Teilchen, unregelmäßig bewegen scheint es bei der Motilität so als würden die Teilchen einen bestimmten Weg verfolgen.
Hier werden diese nämlich aktiv durch z.B. schwenken oder umrühren des Stoffes bewegt und verteilt.

Brownsche Molekularbewegung Beispiel
Um dir das ganze Besser vorstellen zu können haben wir ein Beispiel für dich vorbereitet.
Eine gute Veranschaulichung für die brownsche Molekularbewegung ist die Demonstration durch Duft im Raum.
Das Ganze hast du wahrscheinlich auch schon einmal in deinem Alltag selbst erlebt, ohne dass dir dieses Prinzip bekannt war, denn bestimmt ist dir im Alltag bereits jemand begegnet der vorher Parfum aufgetragen hat.

Direkt wirst du nichts bemerkt haben aber ein paar Sekunden nachdem diese Person dann an dir vorbei gelaufen ist, vernimmst du den Geruch des Parfums der Person. Aber warum ist das so?
Als die Person das Parfum aufgetragen hat sind in diesem Moment viele Duftpartikel herausgeströmt und an der Person haften geblieben. Diese werden dann mit der Person mitgetragen und weiterhin in die Luft abgegeben.
Wenn die Person also an dir vorbei läuft kommen diese Duftpartikel in Kontakt mit den umgebenden Luftmolekülen, welche sehr viel kleiner als die Duftpartikel sind.
Was vermutest du passiert, laut der brownschen Molekularbewegung, nun?
Erklärung
Durch die dann entstehenden Zusammenstöße der Duftpartikel und Luftmoleküle verbreiten sich die Duftpartikel somit in der Umgebung und tragen somit den Geruch des Parfums weiter.




