Redoxreaktionen sind zu komplex? – In nur 4 Punkten haben wir dir die Redoxreaktion einfach erklärt:
- Was ist eine Redoxreaktion?
- Schritt für Schritt Erklärung des Ablaufs
- Das Oxidations- und Reduktionsmittel
- verständliche Beispiele und sinnvolle Aufgaben
Leg los und downloade dir im Anschluss des Artikels die passenden Lernzettel und Aufgaben mit Lösungen, um für dich das Thema Redoxreaktionen zu verinnerlichen!
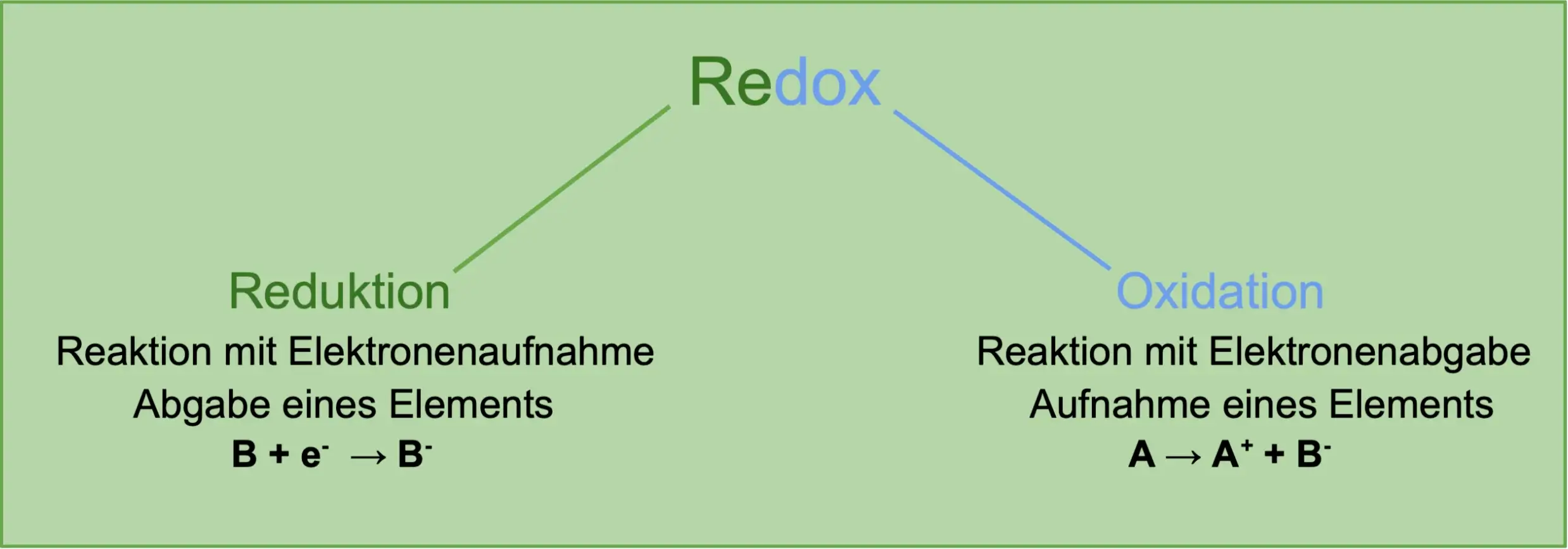
Redoxreaktion Definition – Was ist das?
Bei einer Redoxreaktion handelt es sich um eine chemische Reaktion mit Elektronenübergang. Hier gibt ein Reaktionspartner Elektronen ab und der andere nimmt Elektronen auf. Dieser findet gleichzeitig und abhängig voneinander in Form einer Oxidation und Reduktion statt.
Redoxreaktionen – Schritt für Schritt Erklärung
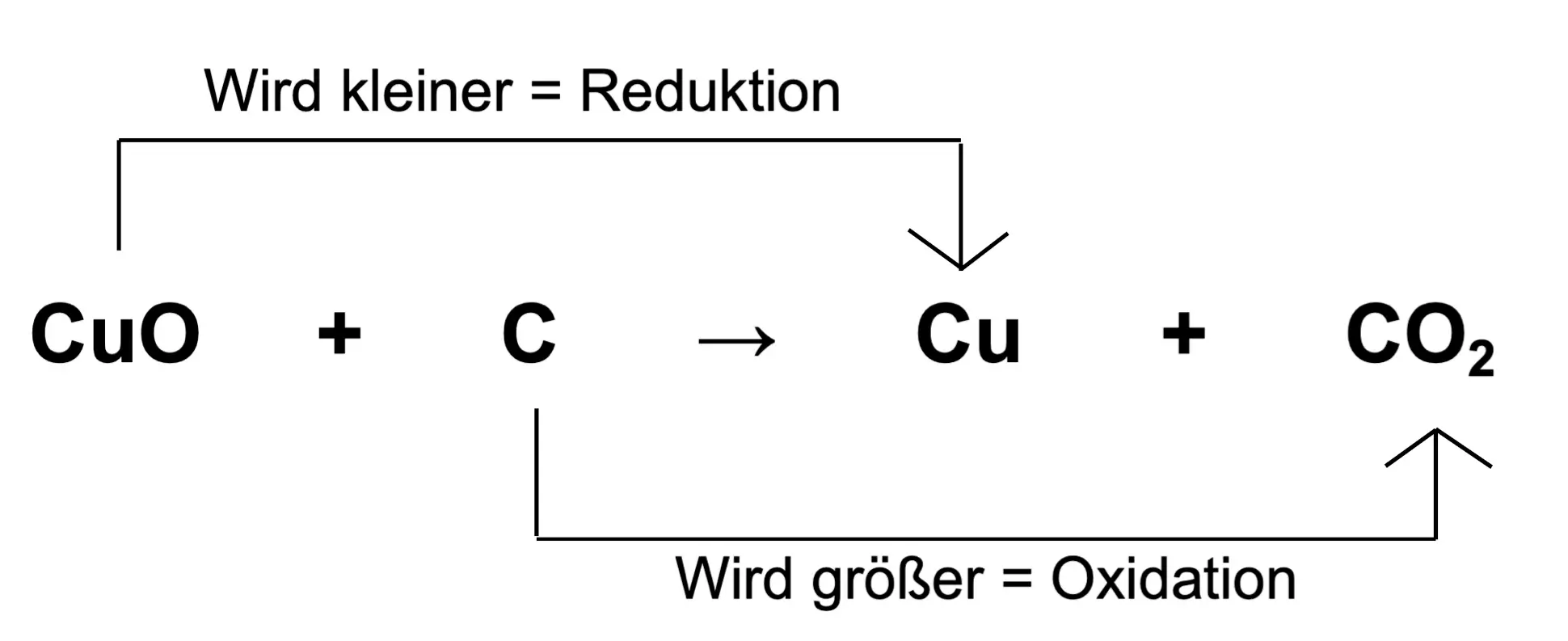
In diesem Teil erklären wir dir Schritt für Schritt das Aufstellen einer Redoxreaktion anhand folgenden Beispiels:
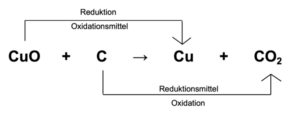
Kupferoxid reagiert mit Kohlenstoff zu reinem Kupfer und Kohlenstoffdioxid.
CuO + C –> Cu + CO2
Klicken und sehen, wie eine Redoxreaktion aufgestellt wird:
Redoxreaktionen aufstellen
Redoxreaktionen aufstellen
1. Oxidationszahlen bestimmen
2. Oxidation
2.1. Abgegebene Elektronen bestimmen
2.2. Ladungsausgleich
2.3. Stoffausgleich mit Wasser
3. Reduktion
3.1. Aufgenommene Elektronen bestimmen
3.2. Ladungsausgleich
3.3. Stoffausgleich mit Wasser
4. Gleichungen kreuzmultiplizieren
5. Gleichung zusammenfassen und kürzen
Schritt 1: Oxidationszahlen bestimmen
Um Oxidationszahlen bestimmen zu können, werfen wir einen Blick ins Periodensystem:

Die Oxidationszahlen schreibt man in der Chemie in römischen Zahlen.
CuO + C → Cu + CO2
Sauerstoff ist in der 6. Hauptgruppe. Da man zur Vereinfachung ab der 4. Hauptgruppe in den meisten Fällen im Periodensystem rückwärts zählt, ergibt sich als Oxidationszahl für Sauerstoff -II.
Kupfer: Damit das Atom neutral ist, muss Kupfer die Oxidationszahl +II besitzen:
-2 +2 = 0
Alleinstehende Atome haben meist die Oxidationszahl null (0), soweit sie keine Ladung haben. Somit besitzt Kohlenstoff die Oxidationszahl null.
+II -II 0
CuO + C
Rechte Seite:
Hier ist Kupfer das alleinstehende Atom und besitzt somit die Oxidationszahl 0.
Kohlenstoff ist in der 4. Hauptgruppe und besitzt damit die Oxidationszahl +IV.
Sauerstoff besitzt wie zuvor auch die Oxidationszahl -II.
Da es sich hier um ein Kohlenstoffdioxid handelt und dementsprechend eine kleine 2 nach dem Sauerstoffatom aufgeschrieben wird, ist auch dieses Atom bereits neutral.
0 +IV-II
Cu + C O2
Schritt 2: Oxidation
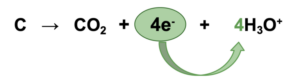
1. Abgegebene Elektronen bestimmen
0 +IV = 4e¯ (4 Elektronen)
C → CO2
Betrachtung des Kohlenstoffatoms, um herauszufinden wieviele Elektronen das Kohlenstoffatom abgegeben hat. Diese werden bei der Oxidation immer auf die rechte Seite geschrieben.
C → CO2 + 4e¯
2. Ladungsausgleich
Der Ladungsausgleich findet in einer sauren/ neutralen Reaktion mit H3O+ und im alkalischen mit OH¯ statt.
Ladung: 0 → IV = 4
C → CO2 + 4e¯
Um einen Ladungsausgleich zu erzielen, sprich auf beiden Seiten eine Ladung von null (0) zu erreichen, müssen 4 H3O+ hinzugefügt werden:
3. Stoffausgleich mit Wasser (H2O)
Im letzten Schritt haben wir die Ladung ausgeglichen. In diesem Schritt müssen wir durch das vorherige Hinzufügen von protoniertem Wasser zum Ausgleich der Ladung nun auch Wasser ausgleichen.
Linke Seite:
Auf der linken Seite befinden sich noch keine Wasserstoff- und Sauerstoffatome.
Rechte Seite:
Auf der rechten Seite befinden sich:

12 Wasserstoffatome
4H3O+ → 4 x 3 = 12

6 Sauerstoffatome
CO2 + 4H3O+ → 2 + 4 = 6
Resultat:
Somit werden 12 Wasserstoffatome und 6 Sauerstoffatome für die linke Seite benötigt. Ausgeglichen wird mit Wasser (H2O).
Um auf beiden Seiten eine ausgeglichene Anzahl an Wasser- und Sauerstoffatomen zu bekommen verwendet man 6H2O.
C + 6H2O → CO2 + 4e¯ + 4H3O+
Schritt 3: Reduktion
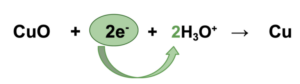
1. Abgegebene Elektronen bestimmen
+II 0 +II -II 0
CuO → Cu CuO + 2e¯ → Cu
2. Ladungsausgleich
Der Ladungsausgleich findet in einer sauren/ neutralen Reaktion mit H3O+ und im alkalischen mit OH¯ statt.
Ladung Links: -2
Ladung Rechts: 0
3. Stoffausgleich mit Wasser (H2O)
Auf der linken Seite befinden sich:

6 Wasserstoffatome
2H3O+ → 2 x 3 = 6

3 Sauerstoffatome
CuO + 2e¯ + 2H3O+ → 1 + 2 = 3
Resultat:
Um auf beiden Seiten eine ausgeglichene Anzahl an Wasser- und Sauerstoffatomen zu bekommen verwendet man 3H2O.
CuO + 2e¯ + 2H3O+ → Cu + 3H2O
Schritt 4: Gleichung kreuzmultiplizieren
CuO + C → Cu + CO2
Oxidationsgleichung: C + 6H2O → CO2 + 4e¯ + 4H3O+
Reduktionsgleichung: CuO + 2e¯ + 2H3O+ → Cu + 3H2O
Gleichung kreuzmultiplizieren:
In diesem Schritt werden die Gleichungen kreuzmultipliziert, um die Gleichung vereinfacht darzustellen und überschüssiges rausstreichen zu können.
Um auf beiden Seiten (Reduktions- und Oxidationsseite) gleich viele Elektronen zu haben, muss die Reduktion x 2 multipliziert werden:
2CuO + 4e¯ + 4H3O+ → 2Cu + 6H2O
Schritt 5: Gleichung zusammenfassen und kürzen
CuO + C → Cu + CO2
Oxidationsgleichung: C + 6H2O → CO2 + 4e¯ + 4H3O+
Reduktionsgleichung: CuO + 2e¯ + 2H3O+ → Cu + 3H2O /x2
___________________________________________________________
Kreuzmultiplizierte Gleichung: 2CuO + 4e¯ + 4H3O+ → 2Cu + 6H2O
Zusammengefasste Gleichung: 2CuO + 4e¯ + 4H3O+ + C + 6H2O → 2Cu + 6H2O + CO2 + 4e¯ + 4H3O+
2CuO + C → 2Cu + CO2
Das Oxidationsmittel und Reduktionsmittel
Das Reduktionsmittel bildet gemeinsam mit dem Oxidationsmittel ein korrespondierendes Redoxpaar und befinden sich somit im Redoxgleichgewicht.
Derjenige Reaktionspartner, der Elektronen im Laufe der Reaktion abgibt ist das Reduktionsmittel (Elektronenspender (-donator)).
Derjenige Redoxpartner, der Elektronen im Laufe der Reaktion aufnimmt ist das Oxidationsmittel (Elektronenempfänger(-akzeptor)).
Merkkasten
Oxidationsmittel:
Oxidiert, wird selber reduziert
Reduktionsmittel:
Reduziert, wird selbst oxidiert
Redoxreaktionen – Beispiel
Kaliumpermanganat reagiert mit Eisensulfat im sauren Milieu zu Mangan(II)- Ionen und Eisen(III)- Ionen
MnO4¯ + Fe²+ → Mn²+ + Fe³+
1. Oxidationszahlen bestimmen
+VII -II +II +II +III
Mn O4¯ + Fe²+ → Mn²+ + Fe³+
Ladung des Ions ist durch die kleine “2+” bereits angegeben
2. Teilgleichung: Oxidation
Fe²+ → Fe³+ + e¯
Die Ladung muss in diesem Fall nicht ausgeglichen werden, da sie bereits auf beiden Seiten gleich. Dementsprechend ist auch kein Stoffausgleich nötig.
3. Teilgleichung Reduktion
MnO4¯ + 5e¯ → Mn²+
MnO4¯ + 5e¯ + 8H3O+ → Mn²+
MnO4¯ + 5e¯ + 8H3O+ → Mn²+ + 12H2O
4. Gleichung kreuzmultiplizieren
Oxidation: Fe²+ → Fe³+ + e¯ ⁄ ·5
Reduktion: MnO4¯ + 5e¯ + 8H3O+ → Mn²+ + 12H2O
5. Gleichungen zusammenfassen und kürzen:
5Fe²+ + MnO4¯ + 5e¯ + 8H3O+ → 5Fe³+ + 5e¯ + Mn²+ + 12H2O
5Fe²+ + MnO4¯. + 8H3O+ → 5Fe³+ + Mn²+ + 12H2O
Diese Artikel könnten dich auch interessieren:
Hat dir dieser Artikel weitergeholfen?
Lass uns gerne einen Kommentar dar, damit auch wir uns stetig verbessern können!