Mathe in der Chemie? Keine Panik, wir zeigen dir mit den folgenden Drei Punkten wie es einfach geht:
- Die Herleitung der Nernst Gleichung
- eine einfache Schritt für Schritt Erklärung der gesamten Formel
- verständliche Beispiele der Nernst Gleichung
Starte direkt mit dem Lesen und lade dir zum Schluss die passenden Lernzettel zu diesem Artikel herunter. Das reicht nicht? Kein Thema! Wir haben für dich noch ein paar Übungen mit den dazugehörigen Lösungen zusammengestellt.
Galvanische Zelle
Die galvanische Zelle sorgt in unserem Alltag dafür, dass wir unseren Strom “mitnehmen” können. So haben wir beispielsweise die Möglichkeit unser Handy mit einer Powerbank aufzuladen. Die galvanische Zelle wandelt in einer Redoxreaktion chemische Energie in elektrische Energie um.
Besuche gerne unseren Artikel über die galvanische Zelle und finde mehr über ihren Aufbau und ihre Funktionsweise heraus!
Nernst Gleichung – Herleitung
Um die Spannung zwischen beiden Halbzellen der galvanischen Zellen zu messen wird i.d.R. ein Spannungsgerät genutzt. Man kann die Zellspannung allerdings auch ausrechnen. Um diese zu berechnen, wird dann die Nernst Gleichung verwendet.
Nernst Gleichung – Zellspannung
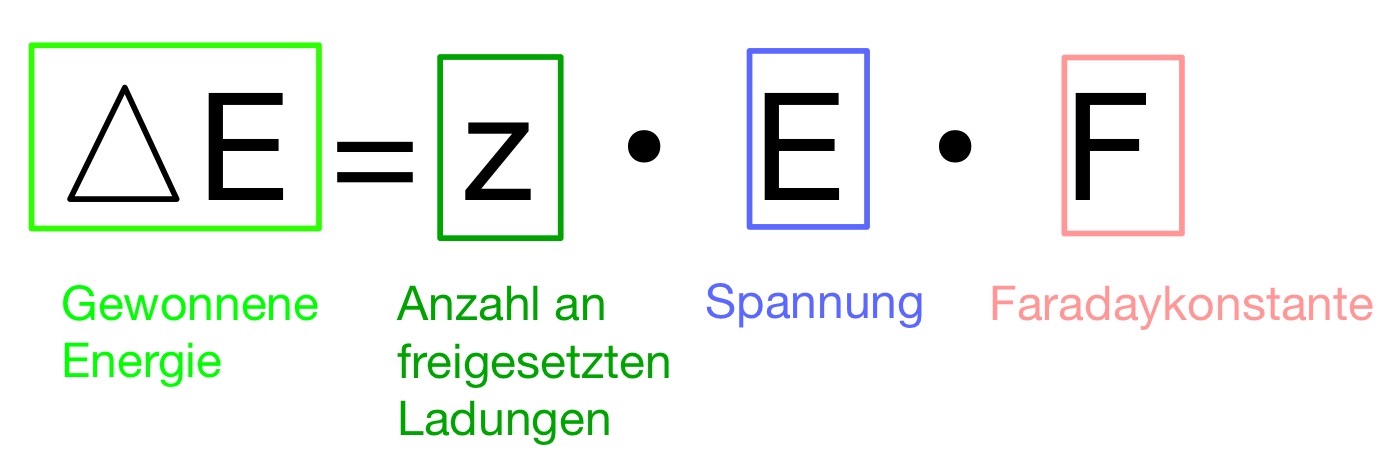
Der Grund warum Strom entsteht lässt sich auf die Spannung zwischen der Oxidations- und Reduktionshalbzelle zurückführen. Die Energie, die dabei zustande kommt lässt sich wie folgt berechnen:

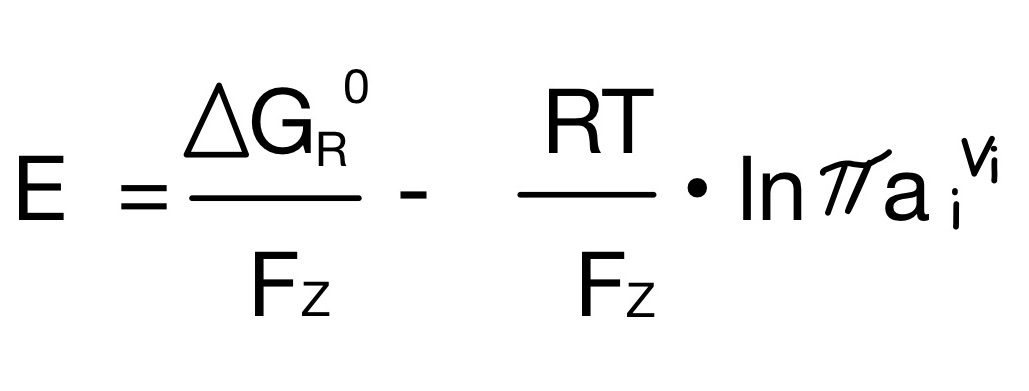
Wenn jedes Atom des Mols ein Elektron abgibt, wird die Faradaykonstante F für “n ⋅ e ⋅ A” eingesetzt. Diese stellt dar, wieviel Ladung in einem Mol enthalten sind. Somit ergibt sich folgende Gleichung:
Nernst Gleichung – Zellspannung in Abhängigkeit der Konzentration
Im Laufe der Reaktion verringern sich die Spannung und die Elektrolyte im selben Ausmaß. Man erkennt also, dass die freiwerdende Energie konzentrationsabhängig ist. Um die Energie bestmöglich zu beschreiben, unter Berücksichtigung der freiwerdenden Energie und der Konzentration, wird die Reaktionsenthalpie verwendet.
Wie die freie Enthalpie eintritt, gibt die Reaktionsenthalpie an.
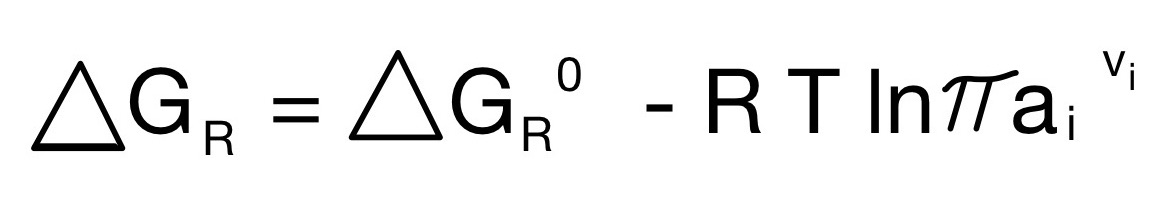
Nernst Gleichung – Allgemein
Setzt man beide Gleichungen gleich und stellt sie nach E um, so bekommt man die Nernst Gleichung:
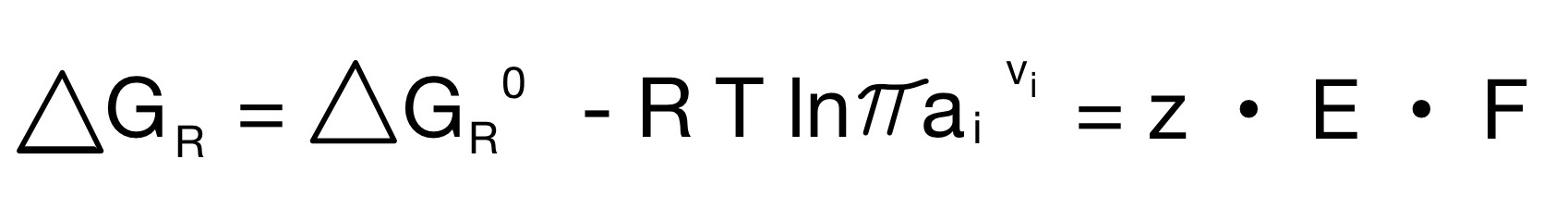
Nernst Gleichung – Anwendung
Zur Vereinfachung der Nernst Gleichung wird folgende Formel verwendet:
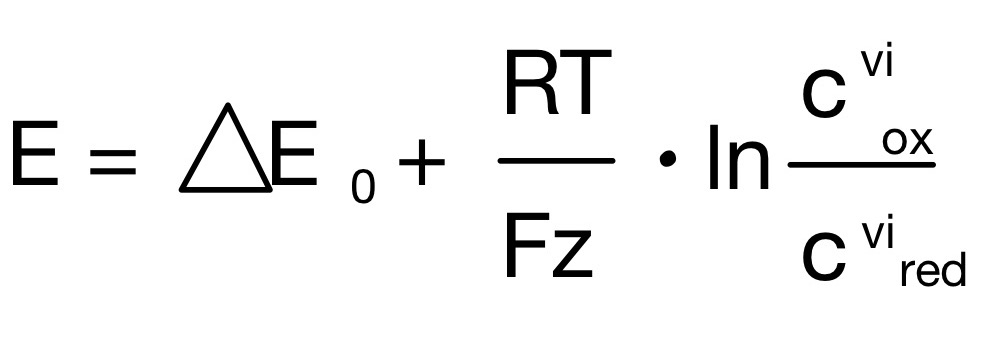
Bei dieser kann:
- beim stöchiometrischen Koeffizienten auf das Vorzeichen verzichtet werden
- das Standardpotenzial aus der Redoxreihe verwendet werden
Nernst Gleichung – Beispiel
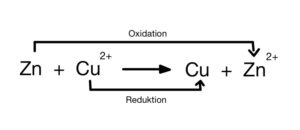
Ergänzend zu unserem Artikel bezüglich der galvanischen Zelle wenden wir die Nernst Gleichung am Beispiel von einer Zink – Kupfer – Zelle an:
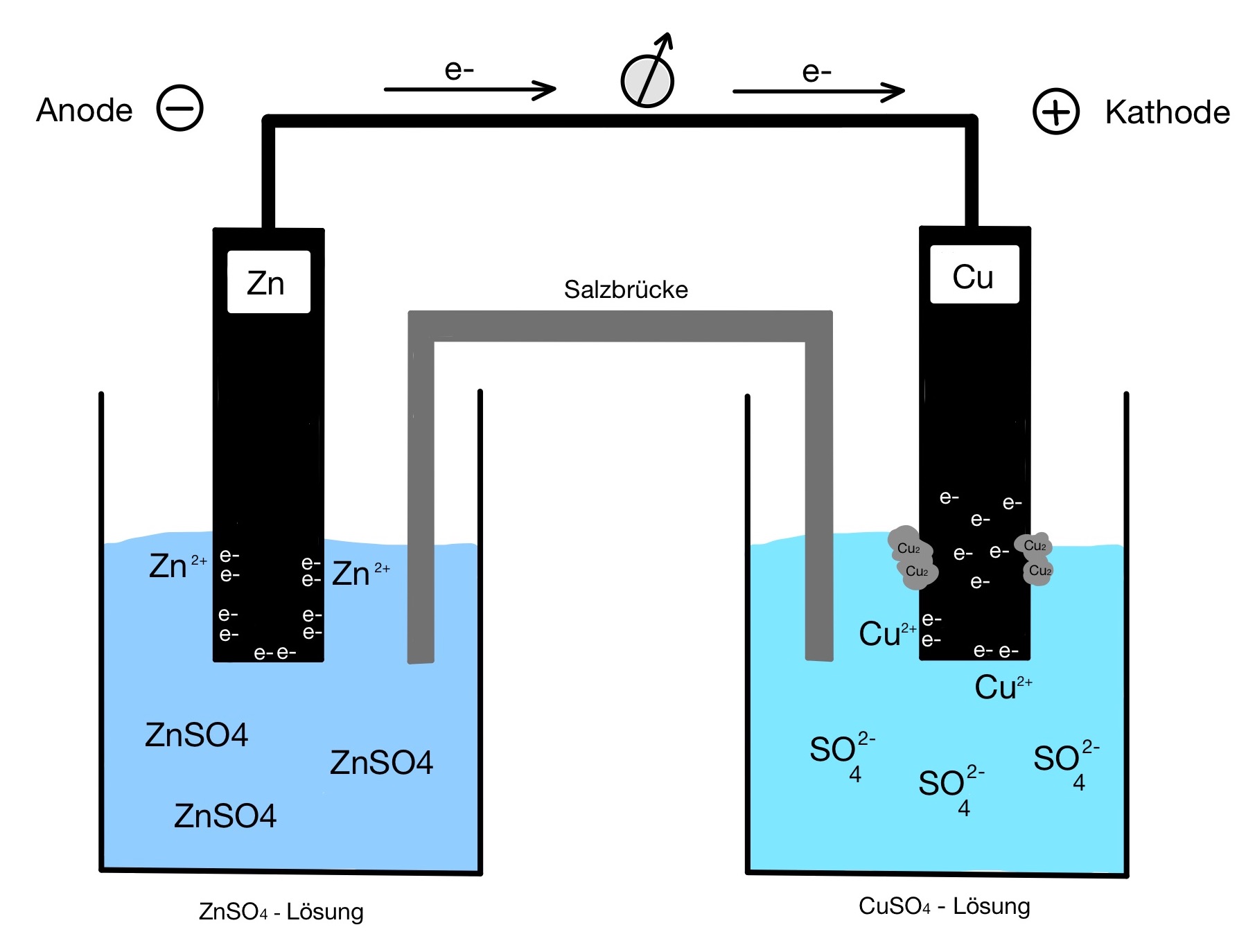
Schritt 1: Redoxreaktion aufstellen
Oxidation: Zn → Zn²+ + 2e¯
Reduktion: Cu²+ + 2e¯→ Cu
Schon hier kann man die Elektronen (z=2) bestimmen, die man für die Nernst Gleichung benötigt.
Schritt 2: Weitere Angaben herausarbeiten
Berechnung
Zelldiagramm:
Zn / Zn²+ (1 mol/ l) // Cu²+ (1 mol/ l) / Cu
Wie man oben aus dem Zelldiagramm ablesen kann, befinden sich in beiden Halbzellen eine 1 molare Lösung.
c = 1 mol/l
E0 (Zn/Zn²+) = -0,76
E0 (Cu²+/Cu) = +0,34
Berechnung in Abhängigkeit der Konzentration
Zelldiagramm:
Zn / Zn²+ (0.1 mol/ l) // Cu²+ (1 mol/ l) / Cu
Wie man oben aus dem Zelldiagramm ablesen kann, befinden sich in beiden Halbzellen eine 1 molare Lösung.
c = 1 mol/l
c = 0,1 1 mol/l
E0 (Zn/Zn²+) = -0,76
E0 (Cu²+/Cu) = +0,34
Schritt 3: Gleichung zusammenfügen und ausrechnen
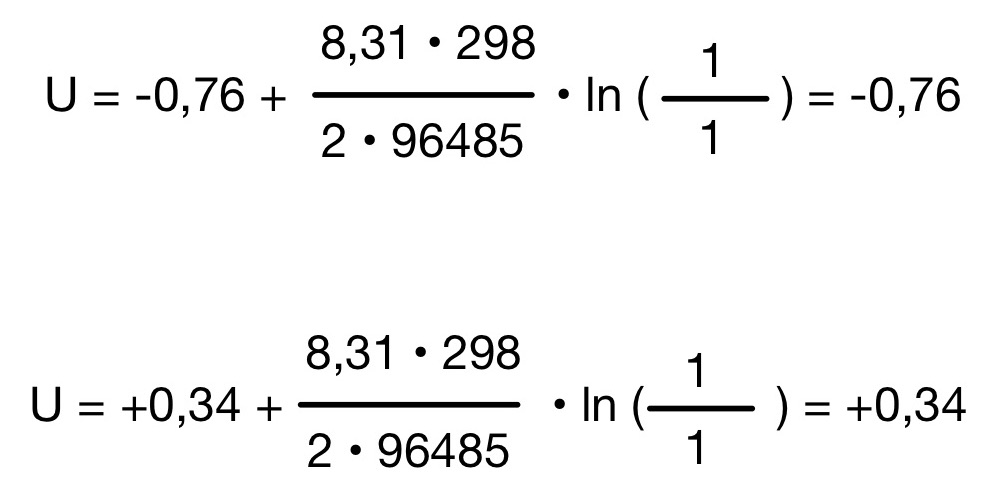
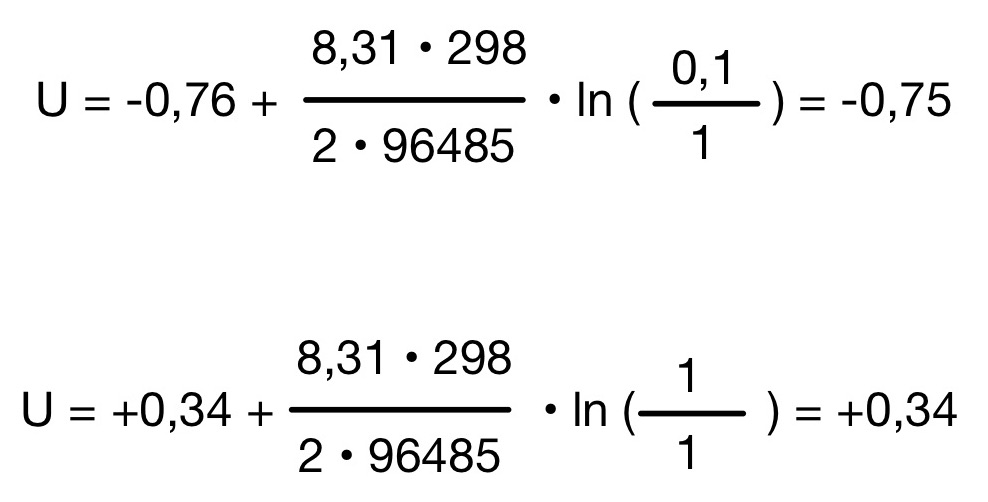
Nernst Gleichung – Membranspannung
Das Potenzial der Oxidations Halbzelle muss von dem Potenzial der Reduktion Halbzelle abgezogen werden.
E (Oxidation) – E (Reduktion)
0,34 – (-0,76) = 1, 1 V
Das Potenzial der Oxidations Halbzelle muss von dem Potenzial der Reduktion Halbzelle abgezogen werden.
E (Oxidation) – E (Reduktion)
0,34 – (-0,75) = 1,09 V
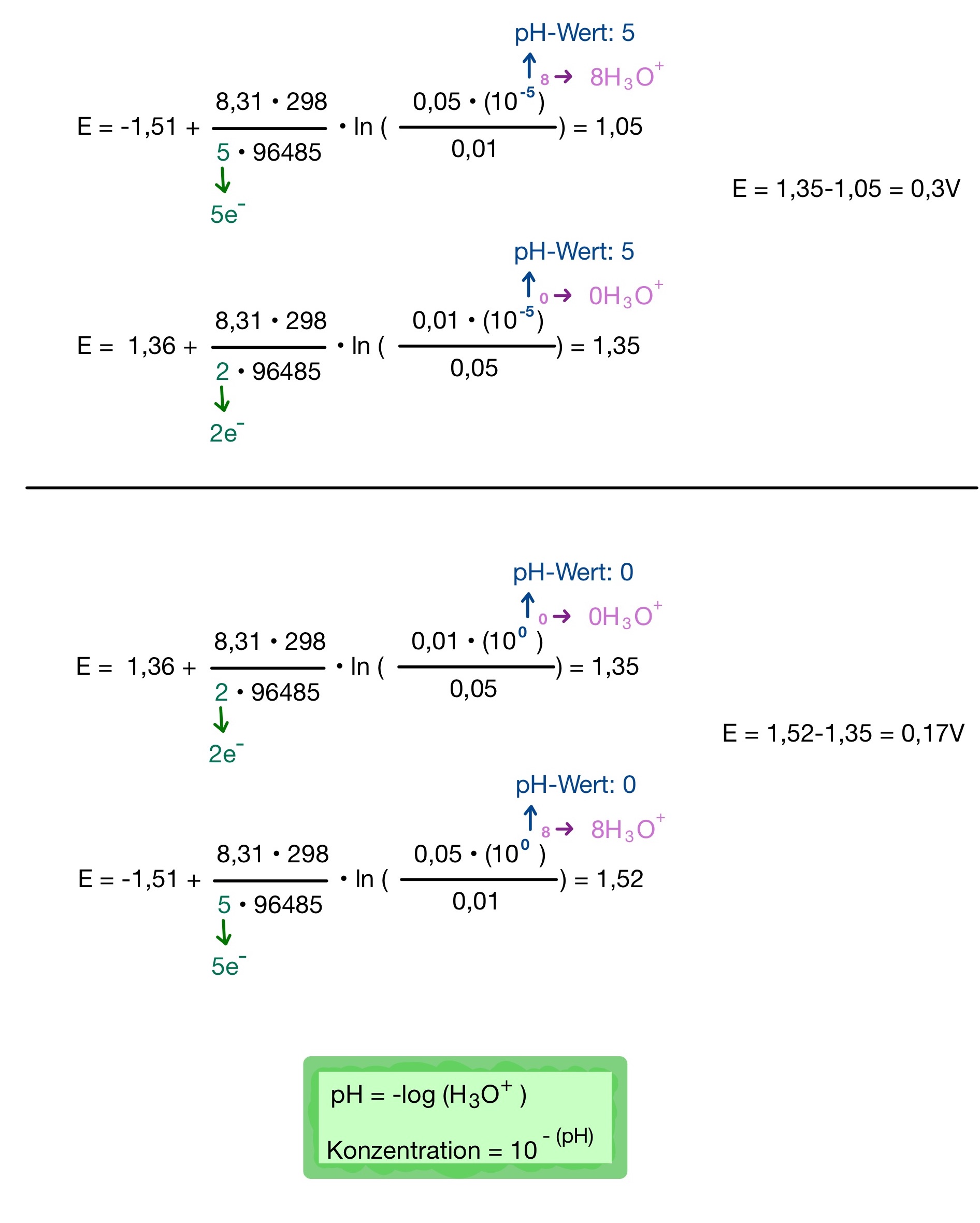
Nernst Gleichung – pH – Wert – und Konzentrationsberechnung
Beispiel: MnO4¯ + Cl¯ → Cl2 + Mn²+. pH= 0, pH= 5, Konzentration 2Cl¯ (0,01)/ Cl2(0,05) // Mn2+ (0,01) / MnO4¯(0,05)
_______________________________________
Oxidation: 2Cl¯ → Cl2 + 2e¯
Reduktion: MnO4¯ + 5e¯ +8H3O+ → Mn2+ + 12H2O
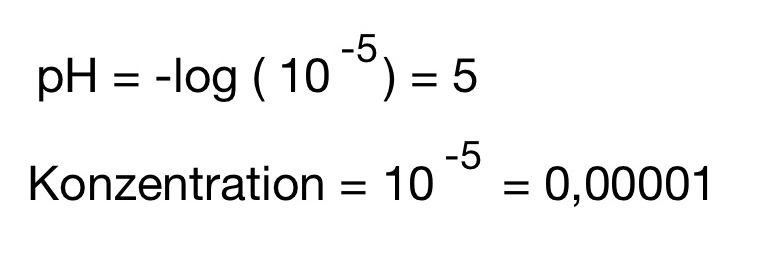
Diese Artikel könnten dich auch interessieren: