Die Halogene sind die 7. Hauptgruppe des Periodensystems. Wir zeigen dir, was du alles über diese Gruppe wissen musst.
Ob es etwas über die Eigenschaften oder das Reaktionsverhalten ist. Lasst uns dann doch direkt starten!
Was sind Halogene?
Wie oben in der Einleitung erwähnt wurde, bilden die Halogene die 7. Hauptgruppe. Du findest die Halogene in der vorletzten Spalte des Periodensystems.
Die Gruppe besteht aus den Elementen Fluor, Chlor, Brom, Iod, Astat und Tenness. Durch ihre Position im PSE kannst du sagen, dass die Elemente insgesamt 7 Außenelektronen besitzen.
Gemeinsam mit Metallen reagieren Halogen zu Salze. Ihren Namen verdanken sie diesem Reaktionsverhalten, denn ihr Name kommt aus dem Griechischen und bedeutet Salzbildner.
Vorkommen und Gewinnung
Neben vielen anderen Eigenschaften sind Halogene sehr reaktionsfreudig. Deshalb findest du sie nur als Gemisch mit anderen Elementen. Häufig in Form von Halogeniden.
In Salzen wirst du sie auch öfters finden. Dazu gehört auch das bekannte Kochsalz – Natriumchlorid. Dabei reagiert das Alkalimetall Natrium mit dem Halogen Chlor.
Gewinnen kannst du Halogene zum Beispiel durch eine Elektrolyse. Bei diesem Verfahren wird eine Redoxreaktion mit elektrischem Strom erzeugt.

Halogene Eigenschaften
Wir zeigen dir hier, welche Kennzahlen du über die Halogene wissen musst. Einfach auf das Kärtchen mit dem gewünschten Halogen klicken und schon hast du sie im Überblick.
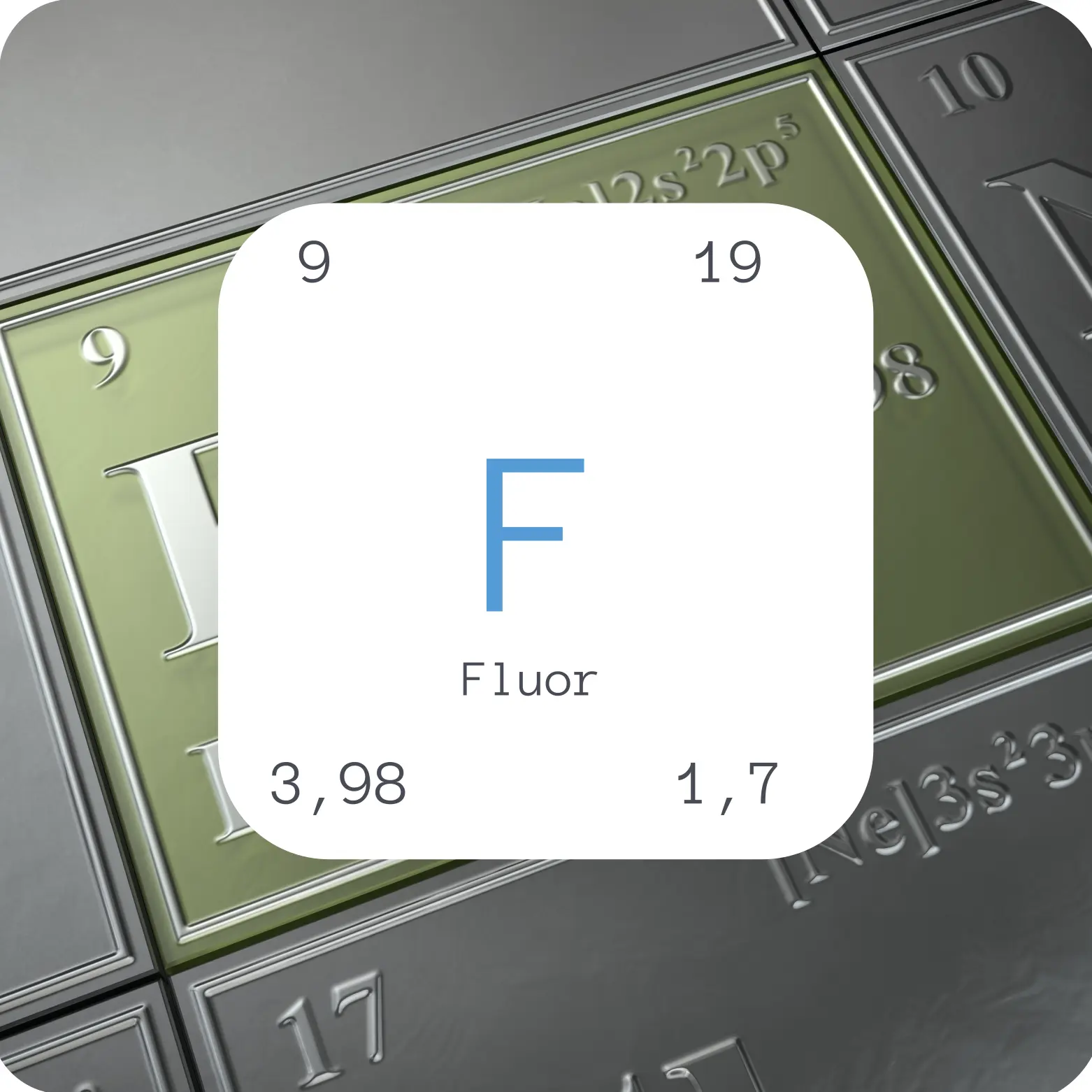
Ordnungszahl | 9 |
Atommasse [u] | 19 |
Dichte [g/m³] | 1,7 |
Schmelzpunkt [°C] | -223 |
Siedepunkt [°C] | -188 |
Elektronegativität | 3,98 |
Ordnungszahl | 17 |
Atommasse [u] | 35,45 |
Dichte [g/m³] | 3,22 |
Schmelzpunkt [°C] | -101 |
Siedepunkt [°C] | -34 |
Elektronegativität | 3,16 |

Ordnungszahl | 35 |
Atommasse [u] | 79,9 |
Dichte [g/m³] | 3,12 |
Schmelzpunkt [°C] | -7 |
Siedepunkt [°C] | 59 |
Elektronegativität | 2,96 |

Ordnungszahl | 53 |
Atommasse [u] | 126,9 |
Dichte [g/m³] | 3,12 |
Schmelzpunkt [°C] | 114 |
Siedepunkt [°C] | 185 |
Elektronegativität | 2,66 |

Ordnungszahl | 85 |
Atommasse [u] | 209,9 |
Dichte [g/m³] | - |
Schmelzpunkt [°C] | 302 |
Siedepunkt [°C] | 335 |
Elektronegativität | 2,2 |

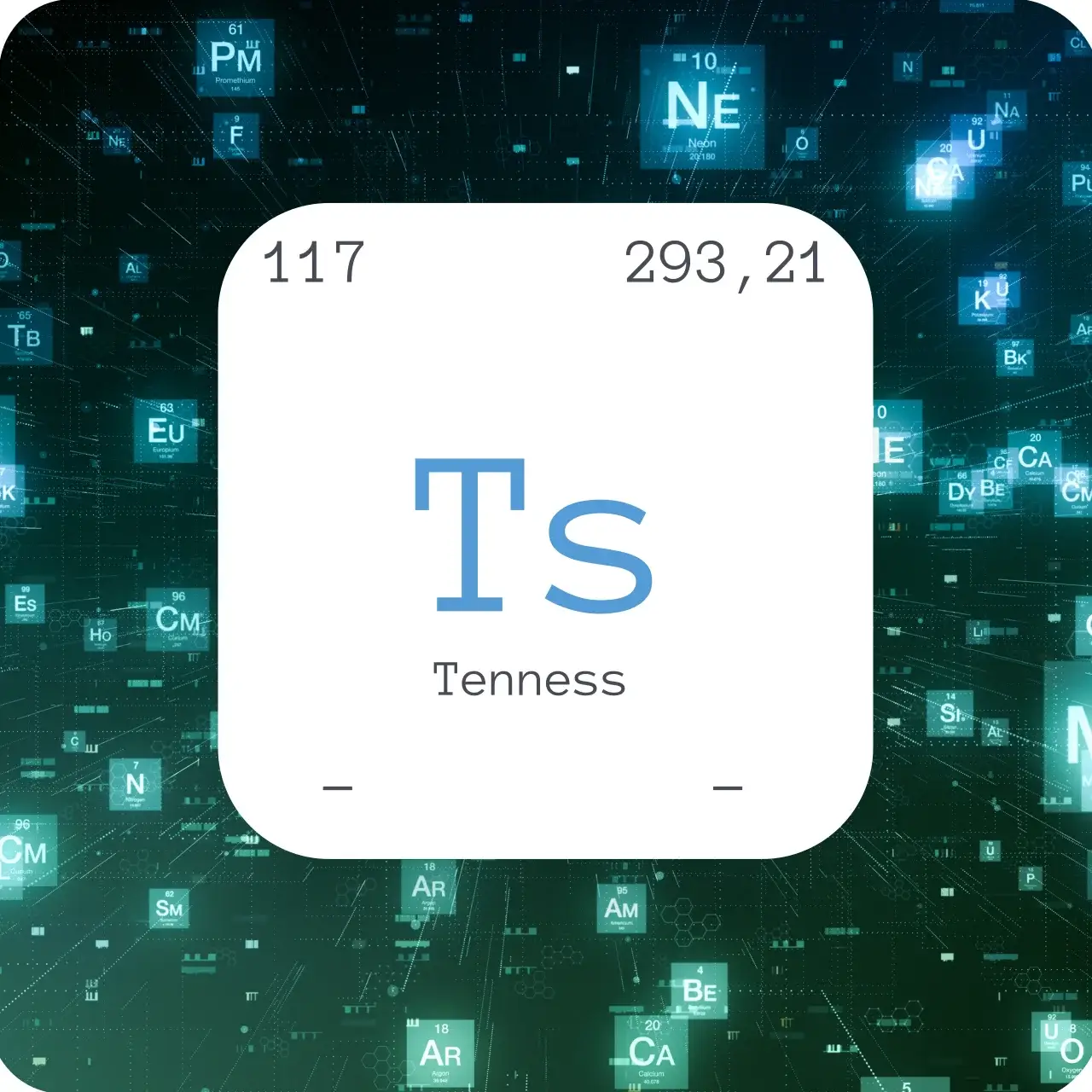
Ordnungszahl | 117 |
Atommasse [u] | 293,2 |
Dichte [g/m³] | - |
Schmelzpunkt [°C] | - |
Siedepunkt [°C] | - |
Elektronegativität | - |
Tenness wird künstlich erzeugt und wegen seiner radioaktiven und instabilen Eigenschaft ist wenig über das Element bekannt.
Eine weitere Eigenschaft oder besser gesagt ein weiteres Merkmal ist der Aggregatzustand bei Raumtemperatur. Während Fluor und Chlor gasförmig sind, ist Brom flüssig und Iod ein Feststoff. Astat ist bei Raumtemperatur auch ein Feststoff, aber aufgrund dessen Radioaktivität zerfällt der Stoff schnell.

Reaktionsverhalten von Halogenen
Jetzt gehen wir noch auf das Reaktionsverhalten der 7. Hauptgruppe ein.
Halogenwasserstoff
Bei der Reaktion mit Wasserstoff (H) entstehen Halogenwasserstoffe (HX). Hier steht das X für ein Halogen.
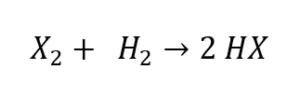
Wenn aber Chlor mit Wasserstoff reagieren soll, müsstest du mit etwas Wärme nachhelfen. Bei dieser Reaktion spricht man auch vom Chlorknallgas, die Reaktion verläuft hier explosionsartig und es entsteht Wasserstoffchlorid (Chlorwasserstoff)
Halogenide
Halogenide entstehen bei der Reaktion von Halogenen und nicht Halogenen. Dazu gehören auch die Reaktionen mit Alkalimetallen.
Hierbei entstehen salzartige Alkalimetallhalogenide (HX). Das bekannteste Salz, das dabei entsteht, ist Kochsalz (Natriumchlorid – NaCl).
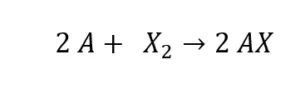
Verbot von Halogenlampen
Ein interessanter Fakt, den du dir merken kannst, ist das Verbot von Halogenlampen. Seit dem 1. September 2021 ist der größte Teil von Halogenlampen verboten und die meisten sollen durch LED-Lampen ersetzt werden. Denn diese sind deutlich stromsparender als die Halogenlampen.

💡 FAQ – Halogene 💡
Möchtest du nochmal alle wichtige Informationen in kompakter Form bekommen? Dann bist du hier genau richtig! Einfach auf das + klicken und schon bekommst du die gewünschte Antwort.
Was sind Halogene?
Halogene bilden die 7. Hauptgruppe des Periodensystems. Wenn Elemente dieser Gruppe mit anderen Stoffen reagieren, reagieren sie zu Salzen. Deshalb bedeutet ihr Name auch Salzbildner.
Fluor – F
Chlor – Cl
Brom – Br
Iod – I
Astat – At
Tenness – Ts
Was entsteht bei der Reaktion mit Wasserstoff bzw. Alkalimetallen?
Halogen + Wasserstoff → Halogenwasserstoff
Halogen + Alkalimetall → Alkalimetallhalogenid
=> bzw.: Halogen + nicht Halogen → Halogenid
Was ist das Besondere an Halogen Lampen?
Die Lampen sind seit dem 01.09.2021 verboten, da sie zu viel Strom verbrauchen. Ersetzt sollen sie durch LED Lampen.
