Die Worte “einfach” und “Carbonsäuren” passen für dich nicht zusammen? Kein Problem! Wir erklären dir das Thema in folgenden Punkten:
- Was sind Carbonsäuren?
- Eigenschaften
- Nomenklatur der Carbonsäuren
- Acidität
- Die Unterscheidungen zwischen den Carbonsäuren
Leg gleich los und vergiss nicht dir am Ende die passenden Lernzettel zu diesem Thema zu downloaden. Natürlich haben wir dir auch hier nochmal ein paar Übungen mit Lösungen zusammengestellt, damit du dein neues Wissen schnell verinnerlichen kannst.
Carbonsäuren-Summenformel
CnH2n+1COOH
Carbonsäuren-Strukturformel
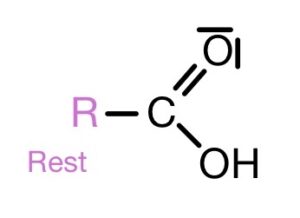
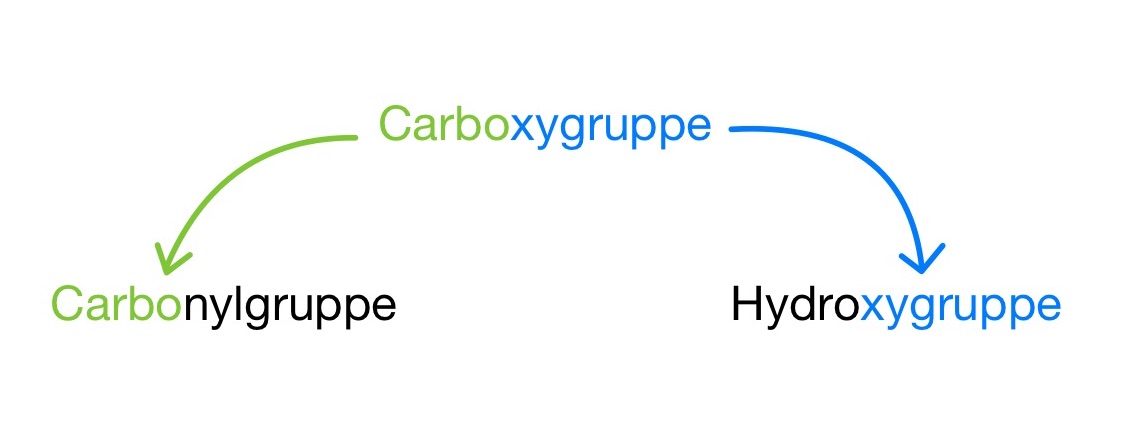
Carbonsäuren werden durch ein Oxidationsmittel (Kaliumpermanganat oder Kaliumdichromat) aus primären Alkoholen hergestellt.
Sie existieren als gesättigte und ungesättigte Säuren. Wie auch bei den Alkanen unterscheiden sie sich dabei in ihrer Bindung:
- Gesättigte besitzen Einfachbindungen.
- Ungesättigte besitzen hingegen Doppel- und Dreifachbindungen.
Carbonsäuren – Eigenschaften
Verhalten in wässriger Lösung
Verbindungen mit einer Carboxygruppe zeigen in wässriger Lösung eine saure Reaktion.
Aggregatzustand
Ungesättigte Carbonsäuren sind flüssig und gehen dann mit den gesättigten Carbonsäuren zu einem festen Aggregatzustand über.
Löslichkeit
Mit polaren Lösungsmitteln mischbar: Ameisen-, Essig-, Propiom- und Buttersäure.
→ Grund dafür ist, dass sie kurzkettig sind
Demnach nimmt die Löslichkeit mit steigender Kettenlänge des unpolaren organischen Restes (hydrophober Kohlenwasserstoffrest) ab.
Langkettige sind demnach in umpolaren Lösungsmitteln gut löslich.
→ Grund dafür ist das Ausbilden von Doppelmolekülen.
Wechselwirkungen
Zwischen Carbonsäuren herrschen Wechselwirkungen. Dies bedeutet, dass sich zwischen den Molekülen Wasserstoffbrückenbindungen ausbilden
Gerüche
Kurzkettige Carbonsäuren: Scharfer Geruch
Folgende Carbonsäuren: Riechen unangenehm nach Schweiß
Langkettige Carbonsäure: Geruchslos
- farblos
- Je kürzer der Alkylrest, desto stärker die Säure
- Reagieren mit Laugen zu Wasser und Salz
- Reagieren mit Alkohol Wasser und Ester
Carbonsäuren – Nomenklatur – Schritt für Schritt
Die Nomenklatur der Carbonsäuren, oder auch Alkansäuren, werden wie bei den Alkanen nach der IUPAC-Regel benannt. Wie diese IUPAC Regel funktioniert haben wir dir in unserem Artikel über Alkane Schritt für Schritt genauer erklärt.
Hier funktioniert die Nomenklatur wie folgt:
Schritt 1: Längste Kohlenstoffkette ermitteln
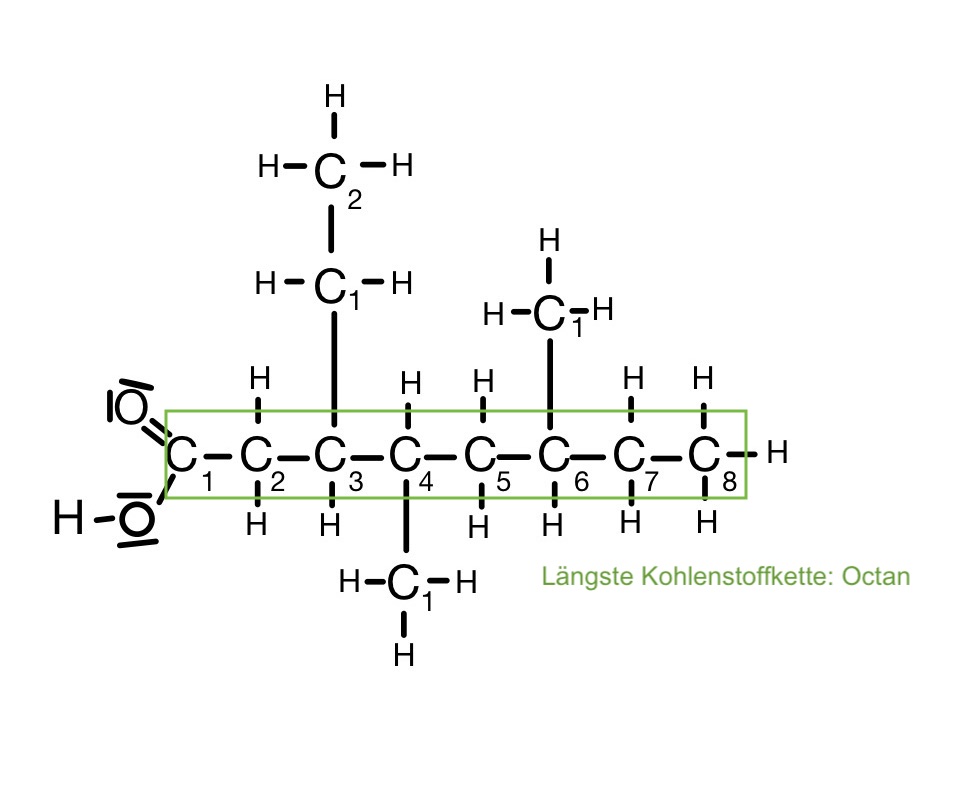
Bei der Nummerierung bekommt das Kohlenstoffatom mit der Carboxygruppe die Nummer 1. Dies liegt daran, dass sie die höchst oxidierte funktionelle Gruppe ist und somit in den Wortstamm mit einbezogen wird.
Schritt 2: Bezeichnung der Seitenketten und der Verzweigungsstellen
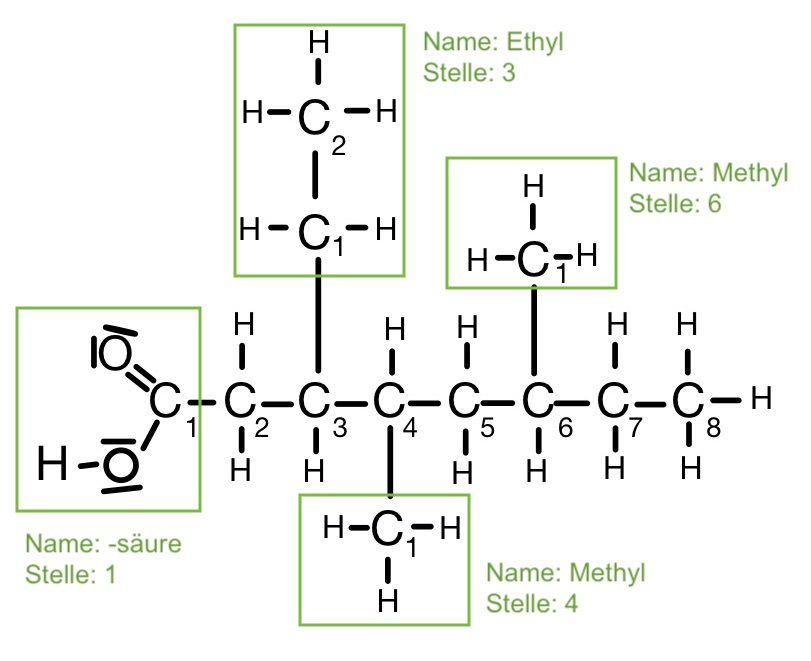
Bei der Nummerierung bekommt das Kohlenstoffatom mit der Carboxygruppe die Nummer 1. Dies liegt daran, dass sie die höchst oxidierte funktionelle Gruppe ist und somit in den Wortstamm mit einbezogen wird.
Schritt 3: Zusammenführung
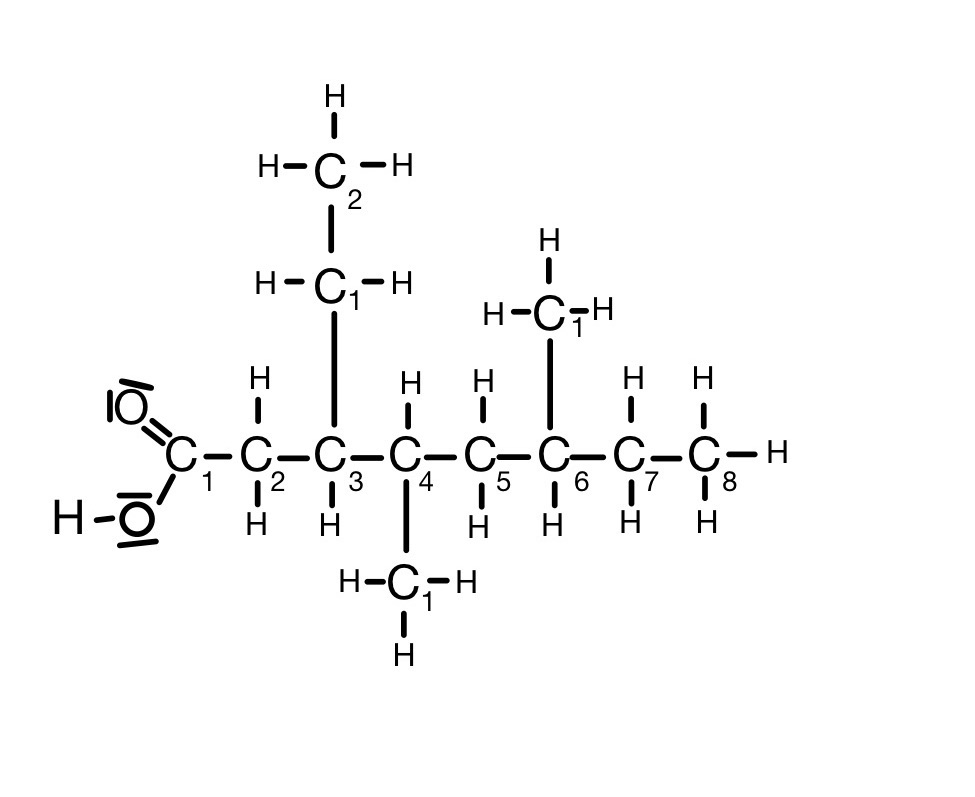
Längste Kohlenstoffkette: Octan
1. Alkylrest
Bezeichnung: Methyl
Verzweigungsstelle: 4, 6
Carboxygruppe
Name: Säure
Verzweigungsstelle: 1
2. Alkylrest
Bezeichnung: Ethyl
Verzweigungsstelle: 3
3-ethyl-4,6-dimethyloctansäure
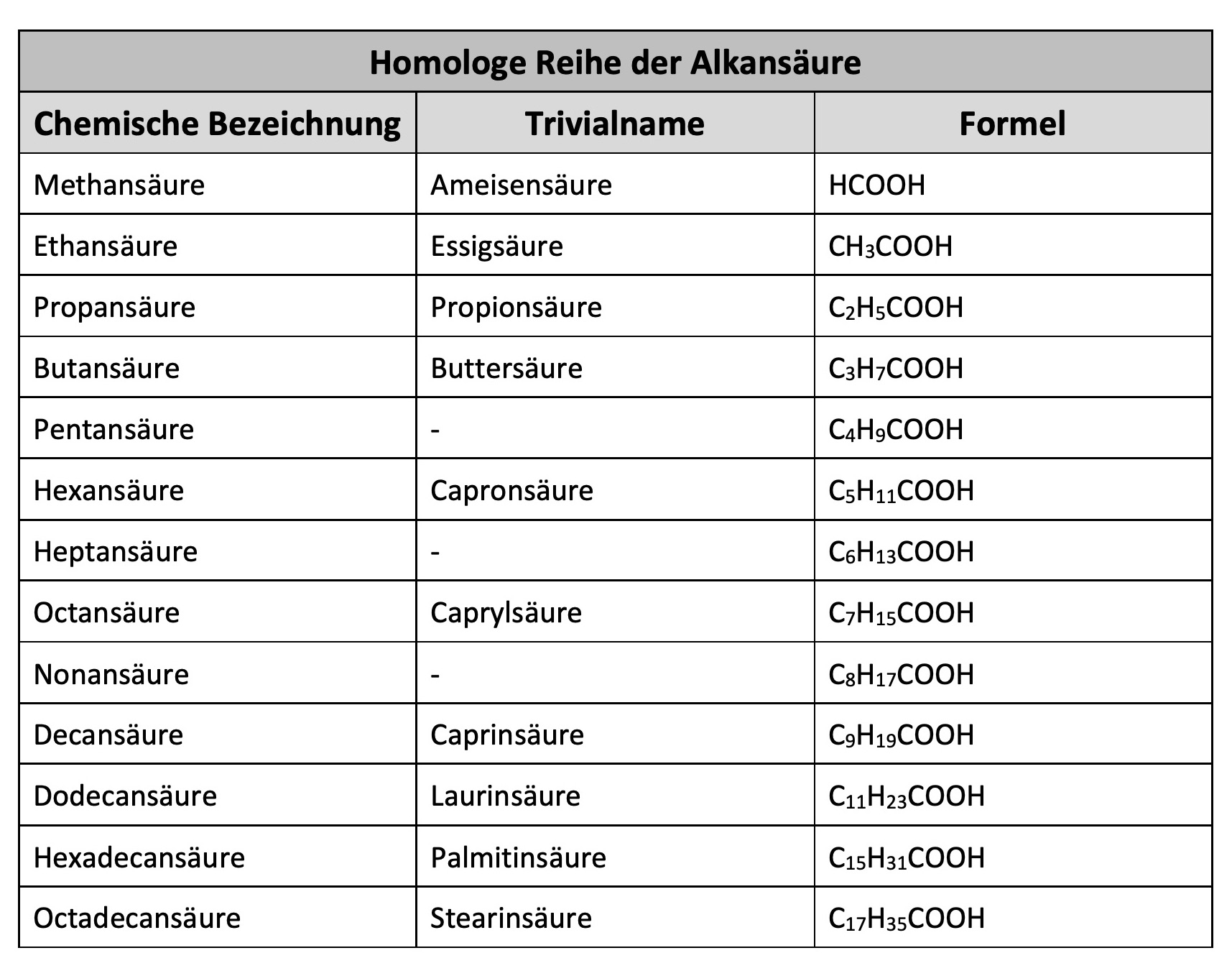
Carbonsäure (Alkansäure) – Homologe Reihe
Die homologe Reihe der Carbonsäure orientiert sich an der der Alkane. Aus diesem Grund nennt man sie auch Alkansäure.
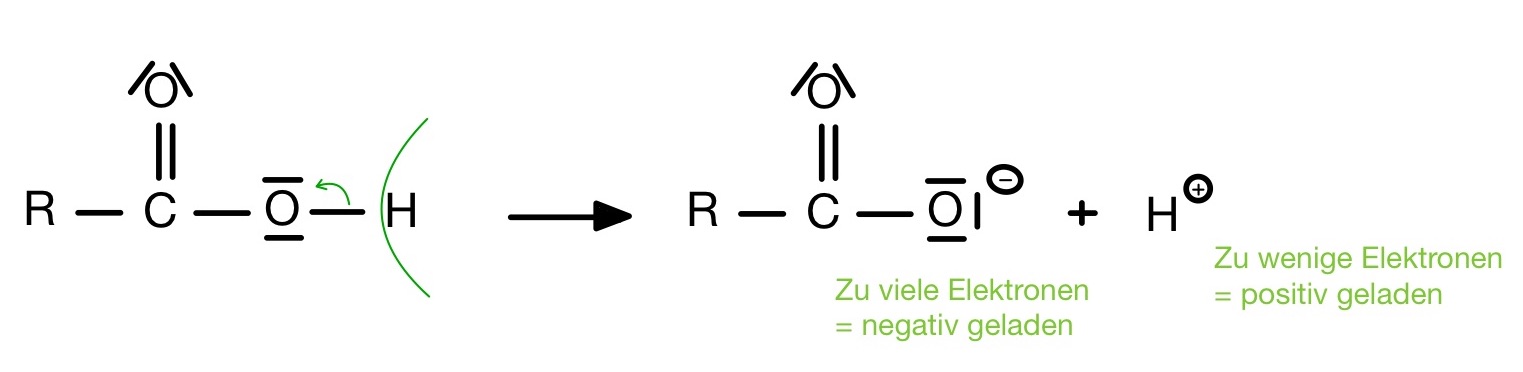
Acidität von Carbonsäuren
Acidität meint die Fähigkeit Protonen in einer chemischen Reaktion abzugeben. Bei den Carbonsäuren handelt es sich um Protonendonatoren. Sie geben also Protonen ab und ein Carboxylation findet statt:
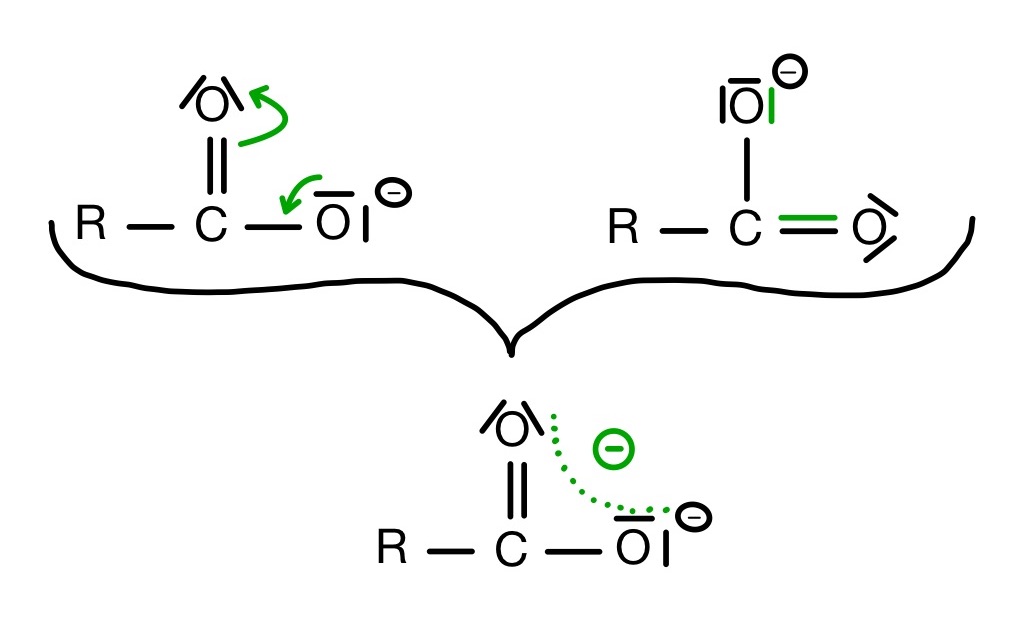
Der Grund, warum sie einfach ein Proton abgeben ist die mesomere Grenzstruktur.
Die negative Ladung ist über die gesamte Carboxygruppe verteilt und nicht nur auf das Sauerstoffatom bezogen. Somit herrscht durch die delokalisierte Ladung Stabilität im Carboxylat-Ion.
Das Sauerstoffatom wirkt aufgrund der hohen Elektronegativität elektronenziehend. Das Kohlenstoffatom wird somit an dichte entzogen. Die Folge: das Kohlenstoffatom ist positiv polarisiert (=Elektronenmangel herrscht).
Um dem Elektronenmangel zu entgehen, zieht es Elektronen aus der O-H-Bindung der Hydroxygruppe, die dadurch schwächer wird. So kann das Wasserstoffatom leichter abgespalten werden.
Unterscheidung der Carbonsäuren
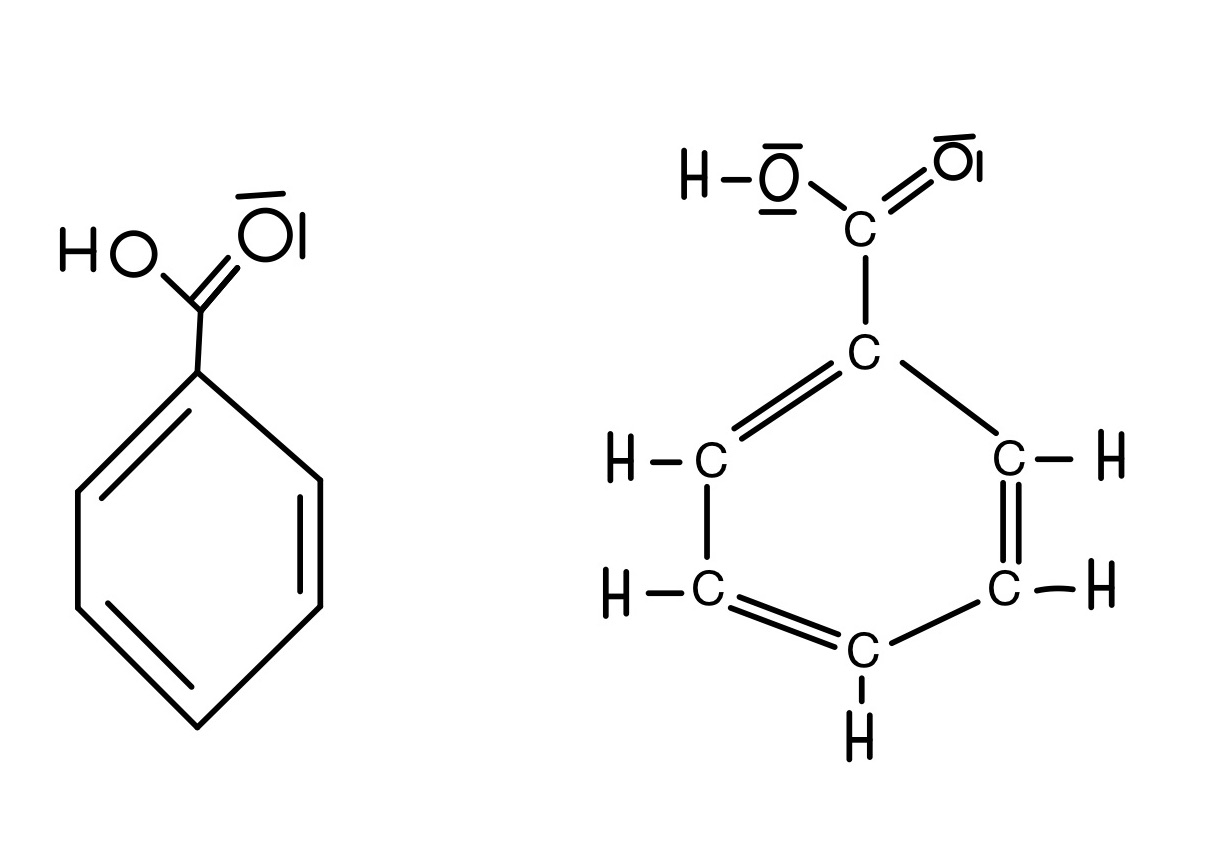
Aromatische Carbonsäuren
Hierbei handelt es sich um aromatische Kohlenwasserstoffe. Diese sind planare und cycliksche Moleküle mit konjugierten Doppelbindungen.
Mono-, Di- und Tricarbonsäuren
Diese drei Arten unterscheiden sich an ihrer Anzahl an Carboxygruppen:
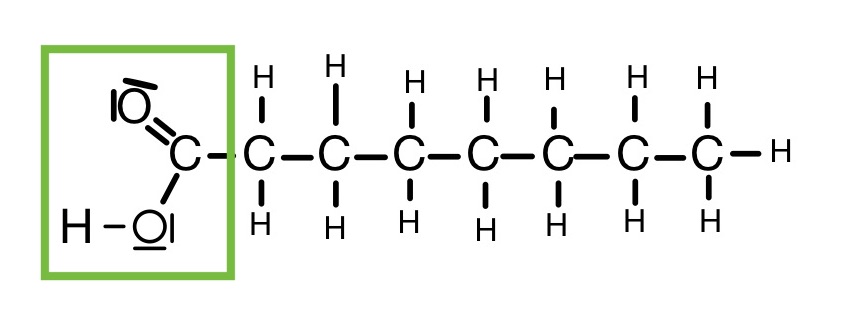
Monocarbonsäure
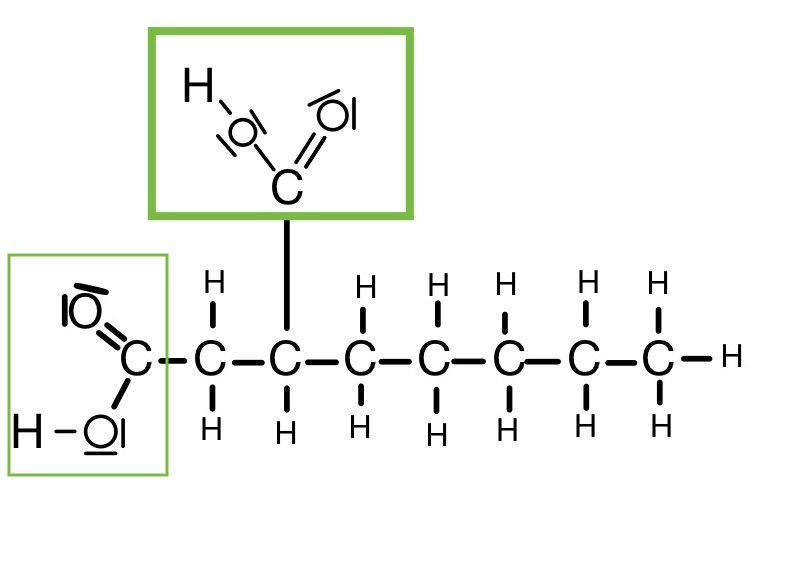
Dicarbonsäure
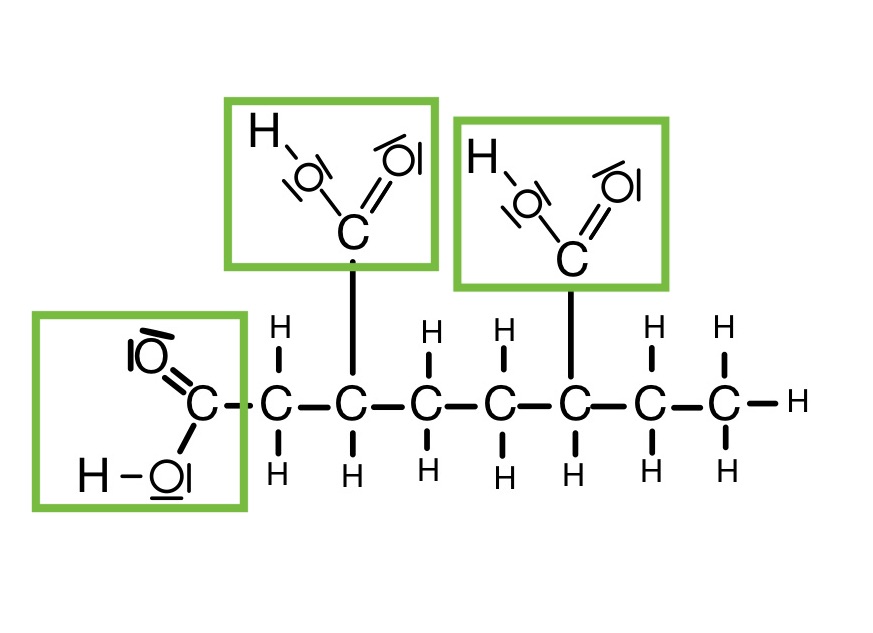
Tricarbonsäure
Diese Artikel könnten dich auch interessieren:

