Das Thema Alkane fällt dir schwer? Keine Sorge! – Wir haben dir die 7 wichtigsten Punkte über Alkane zusammengestellt:
- Alkane – Einfach erklärt
- Tabelle der homologen Reihe
- Die Nomenklatur der Alkane – Schritt für Schritt Erklärung
- Alkane, Alkene, Alkine – Der Vergleich
- Alkane – Eigenschaften
- Reaktionen mit Alkanen
- Alkane – Wo kommen sie vor?
Verlier keine Zeit und lad dir nach dem Lesen am Ende des Artikels die passenden Lernzettel zum Artikel runter! Um das ganze nochmal abzurunden haben wir dir Übungen mit Lösungen zur Nomenklatur nach IUPAC zusammengestellt.
Legen wir direkt los!
Alkane – Einfach erklärt
Alkane sind gesättigte Kohlenwasserstoffe (besitzen die höchste Anzahl an Bindungspartnern). Dem Namen nach bestehen sie nur aus Kohlenstoff (C) und Wasserstoff (H). Gleichzeitig besitzen sie anders als die Alkene und Alkine nur Einfachbindungen.
Alkane können unverzweigt (n-Alkane) oder verzweigt (i-Alkane/ Iso(mere)-Alkane) vorkommen:
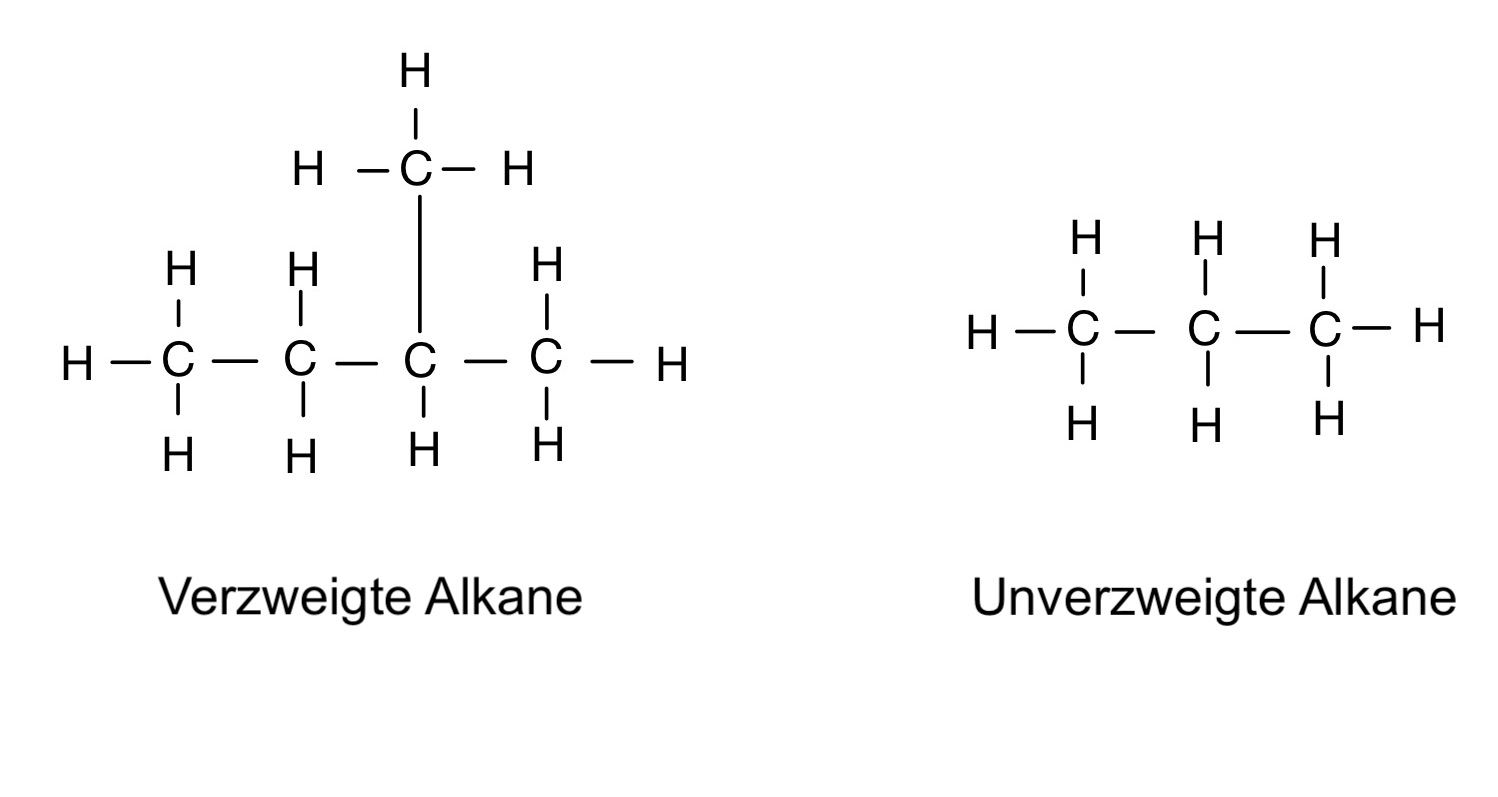
Definition: Alkane
Alkane sind eine Stoffgruppe der gesättigten Kohlenwasserstoffe aus der organischen Chemie. Sie besitzen nur Einfachbindungen und bestehen lediglich aus Kohlenstoff und Wasserstoff. Sie können sowohl verzweigt (Iso-Alkane), als auch unverzweigt (n-Alkane) vorkommen.
Tabelle der homologen Reihe
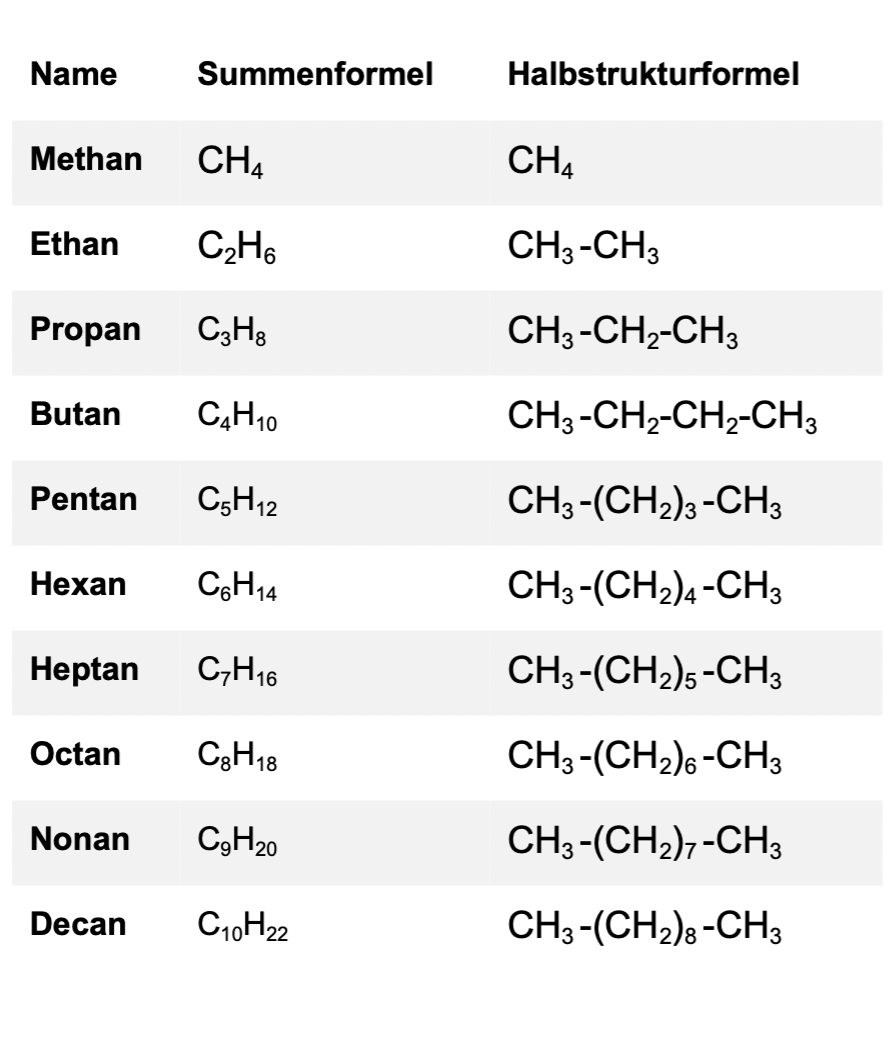
Das Prinzip der homologen Reihe der Alkane baut auf dem Hinzufügen einer CH2-Gruppe auf. Demnach ist das leichteste Alkane: Methan (CH4).
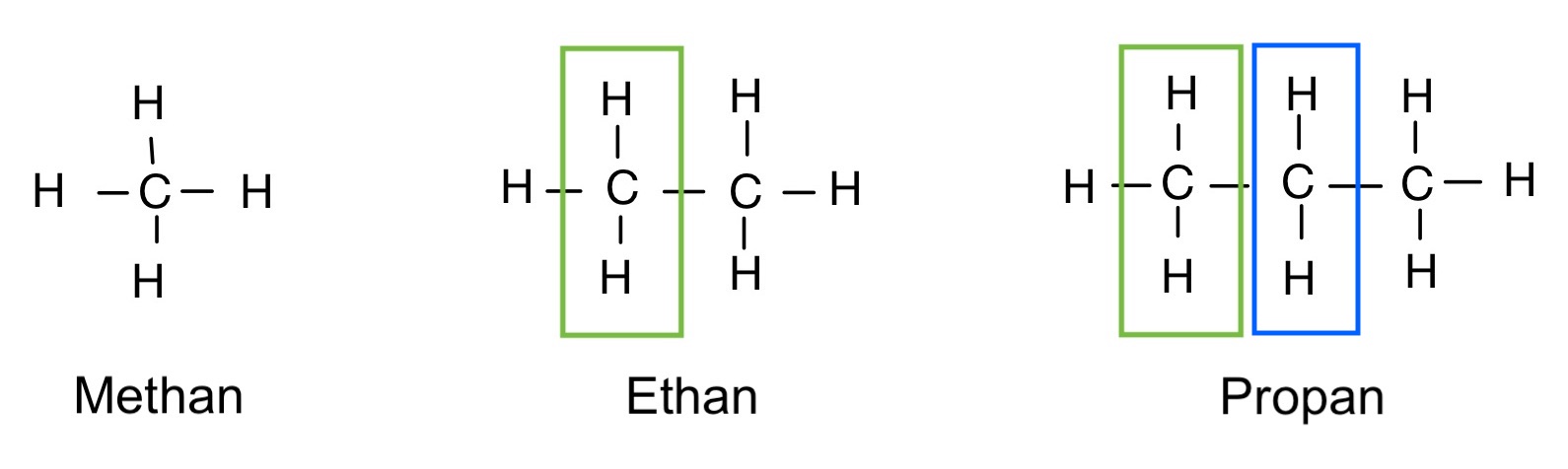
Alkane: Strukturformel
Folgende Tabelle stellt die homologe Reihe der Alkane mit den 10 wichtigsten und unverweilten Alkanen dar:
CH4 -> 1x Kohlenstoffatom (C) und 4x Wasserstoffatom (H)
Allgemeine Summenformel der Alkane
CnH2n+2
n= Anzahl der Kohlenstoffatome (C)
Die Nomenklatur der Alkane – Schritt für Schritt Erklärung
Die Nomenklatur der Alkane erfolgt nach der IUPAC-Nomenklatur. Hierbei geht man nach folgender Regel vor:
1. Die Kohlenstoffatome werden nummeriert.
- Der Stammname wird nach der längsten Kohlenstoffkette gebildet
- Die Seitengruppe (Alkylgruppe) ist die, mit den wenigsten C-Atomen. Demnach ist die Hauptkette so zu nummerieren, dass die Seitengruppe möglichst kleine Ziffern bekommt.
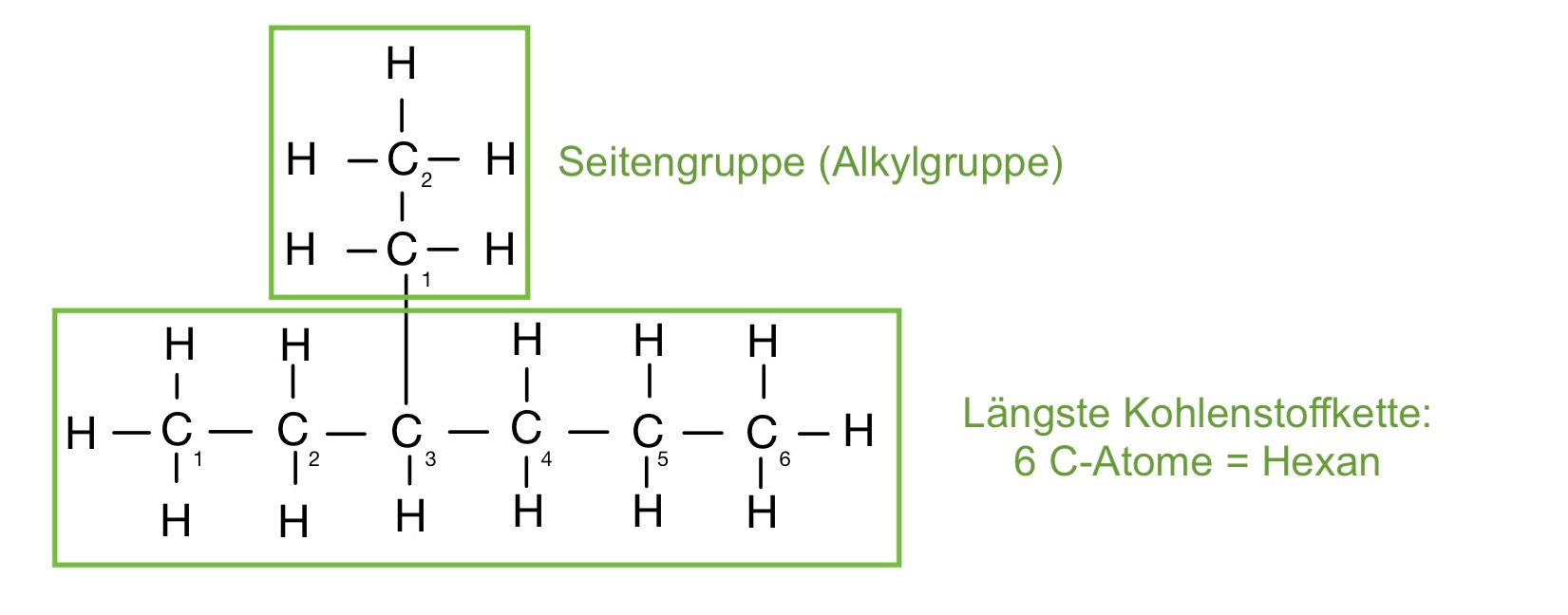
2. Bezeichnung der Seitenkette
Die Bezeichnung der Seitenkette des Alkane funktioniert (Orientierung an der homologen Reihe) durch das Anhängen der Endung -yl: Methyl-, Ethyl-, Propyl-, Butyl-, … . Anschließend werden die Bezeichnungen alphabetisch vor der Stammnamen geschrieben.
3. Bezeichnung der Verzweigungsstelle
Mit Bindestrichen wird die Verzweigungsstelle innerhalb des Alkans (Stelle an dem Kohlenstoffatom, an dem die Alkylgruppe hängt) vor der Alkylgruppe geschrieben.
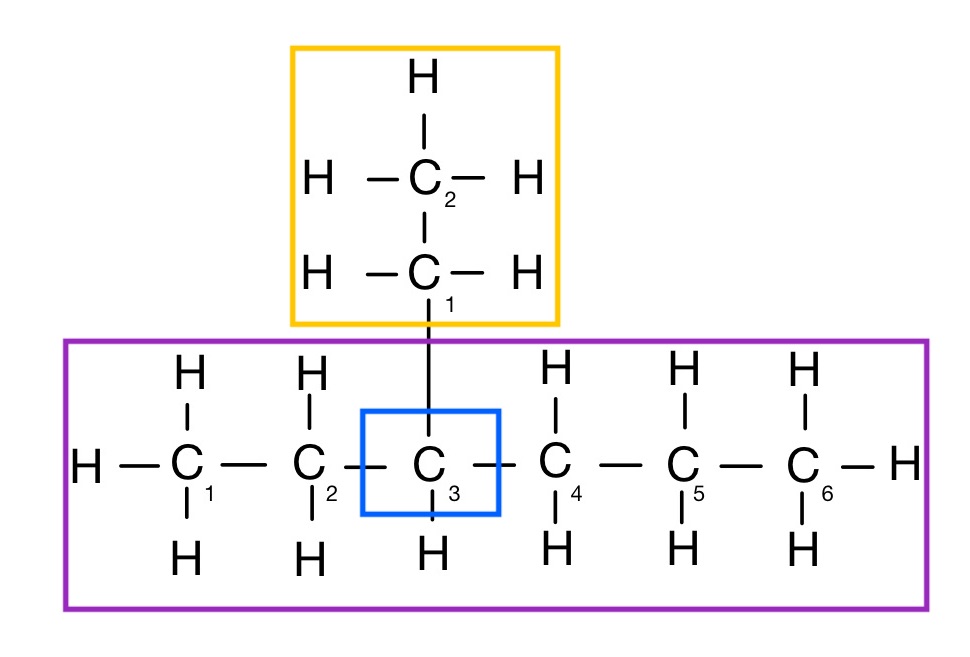
Beispiel:
Stammname des Alkans: Hexan
Alkylgruppenanzahl: 1
Alkylgruppenbezeichnung: Ethyl (2 C-Atome, abgeleitet von Ethan)
Verzweigungsstelle: 3
Lösung: 3–ethylhexan
4. Bezeichnung bei gleichen Alkylgruppen
Bei gleichen Alkylgruppen wird vor der Bezeichnung der Alkylgruppe ein di (2x gleiche Alkylgruppe), tri- (3x), tetra- (4x), penta- (5x), … angehängt.
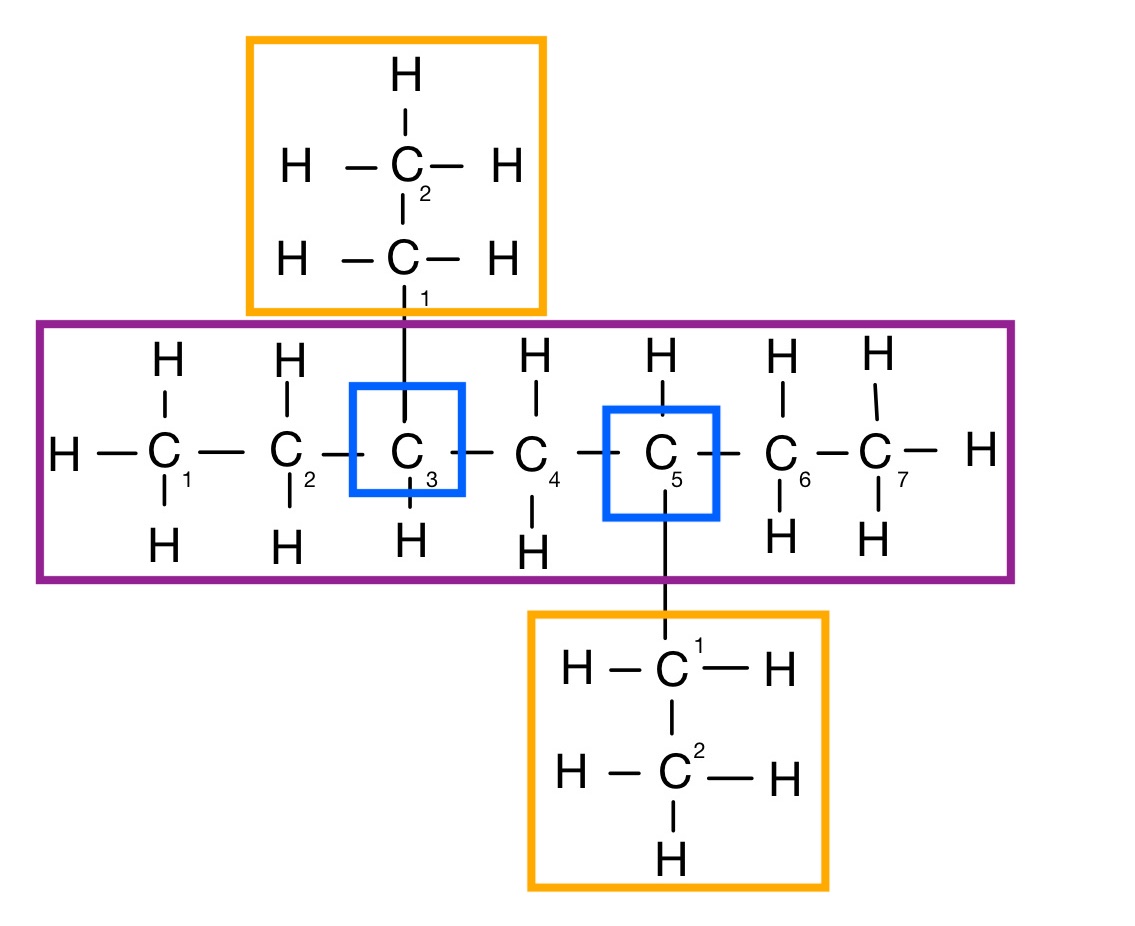
Beispiel:
Stammname des Alkans: Heptan
Alkylgruppenanzahl: 2
Bezeichnung: Ethyl
Verzweigungsstelle: 3, 4
Lösung: 3,5-diethylheptan
5. Bezeichnung bei unterschiedlichen Alkylgruppen
Bei verschiedenen Alkylgruppen werden die alphabetisch vor den Stammnamen geschrieben.
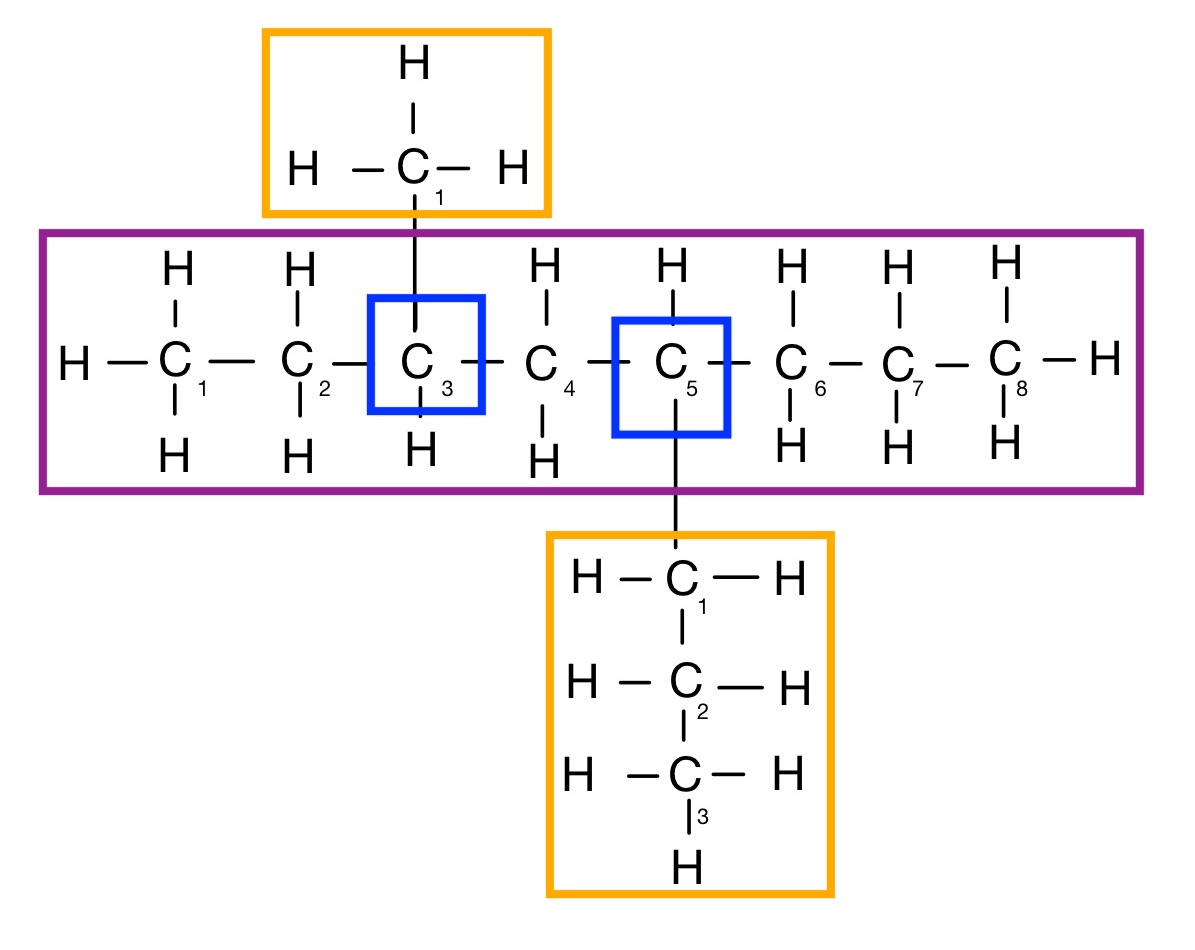
Beispiel:
Eine Methyl-Seitengruppe und eine Propyl-Alkylgruppe. Demnach wird Methyl und Propyl geschrieben.
Stammname des Alkans: Octan
Alkylgruppenanzahl: 2
1. Alkylgruppe
Bezeichnung: Methyl
Verzweigungsstelle: 3
2. Alkylgruppe
Bezeichnung: Propyl
Verzweigungsstelle: 5
Lösung: 3–methyl–5–propyloctan
Nomenklatur der Alkane – Beispiele
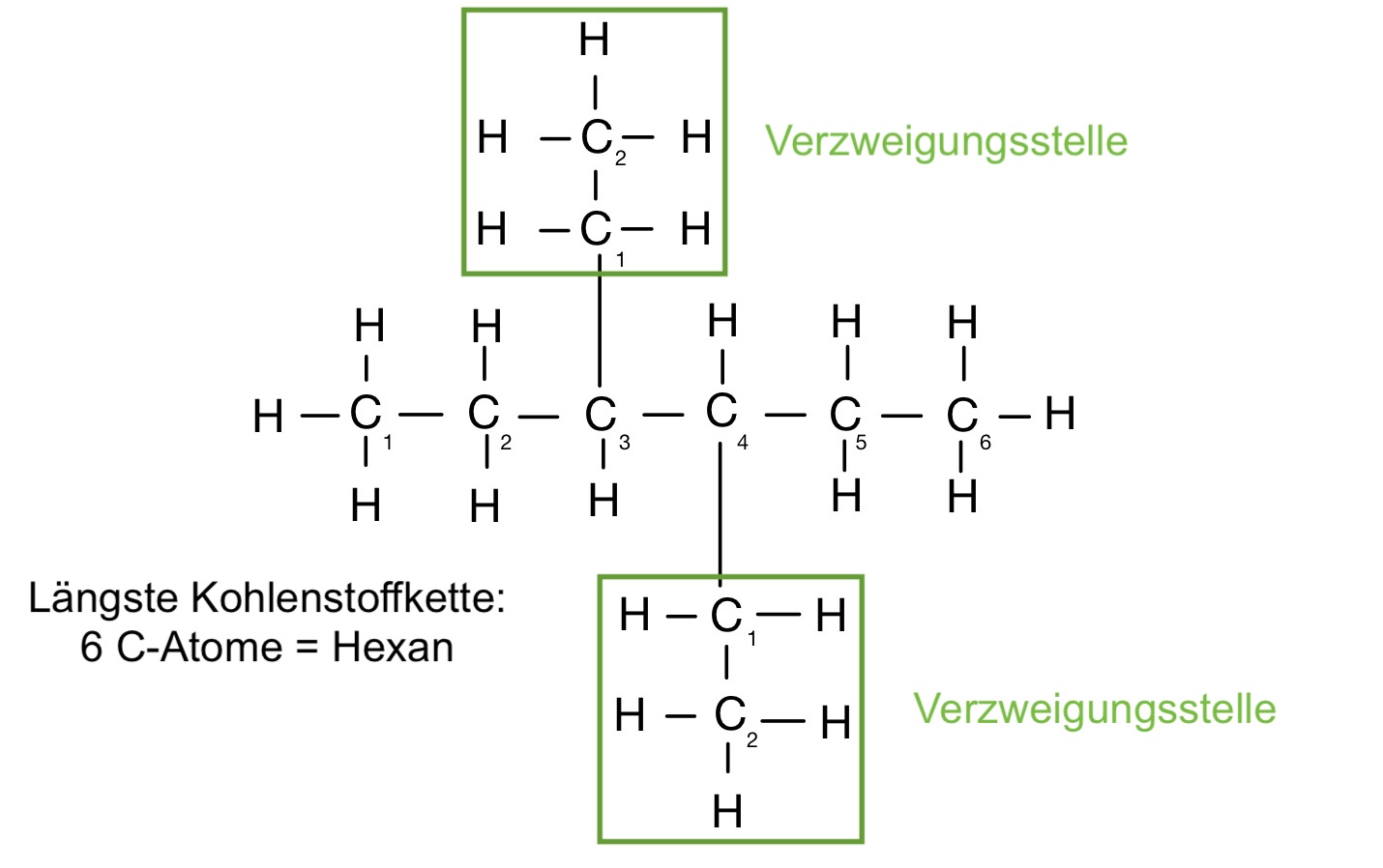
3,4-diethylhexan
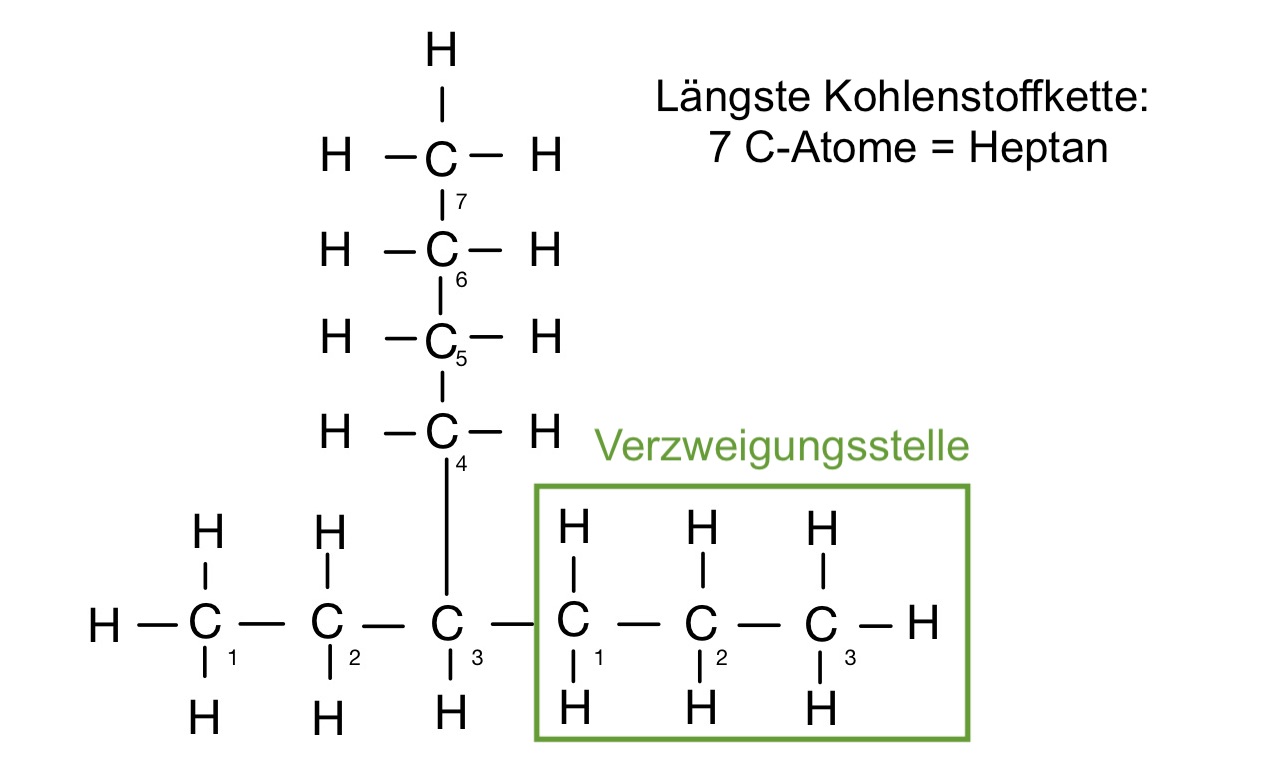
3-propylheptan
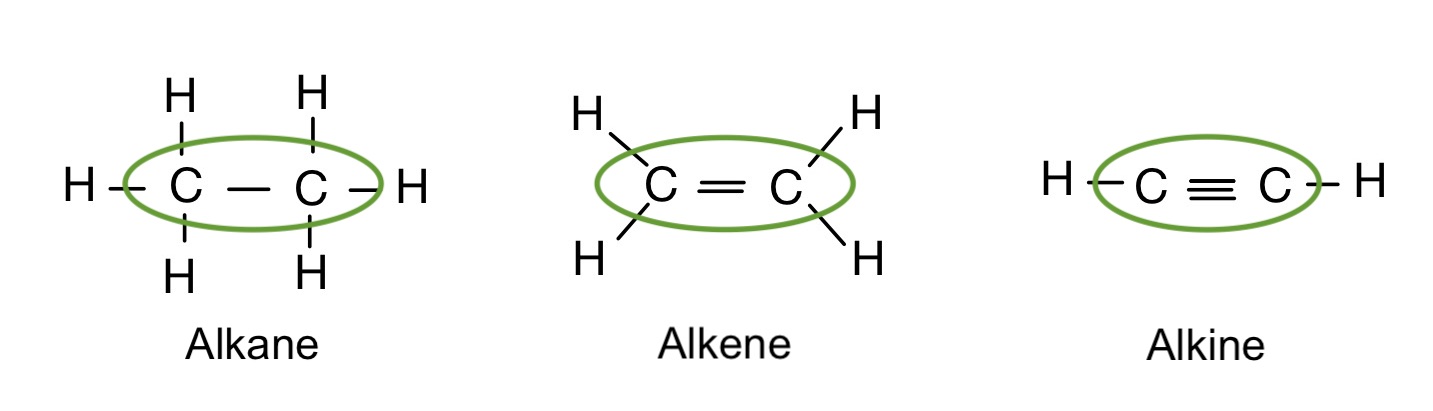
Alkane, Alkene, Alkine – Der Vergleich
Alkene und Alkine gehören anders als die Alkane zu den ungesättigten Kohlenwasserstoffen. Im Allgemeinen unterscheiden sie sich in ihrer Bindung, denn Alkane besitzen eine Einfachbindung, Alkene eine Doppelbindung und Alkine eine Dreifachbindung.
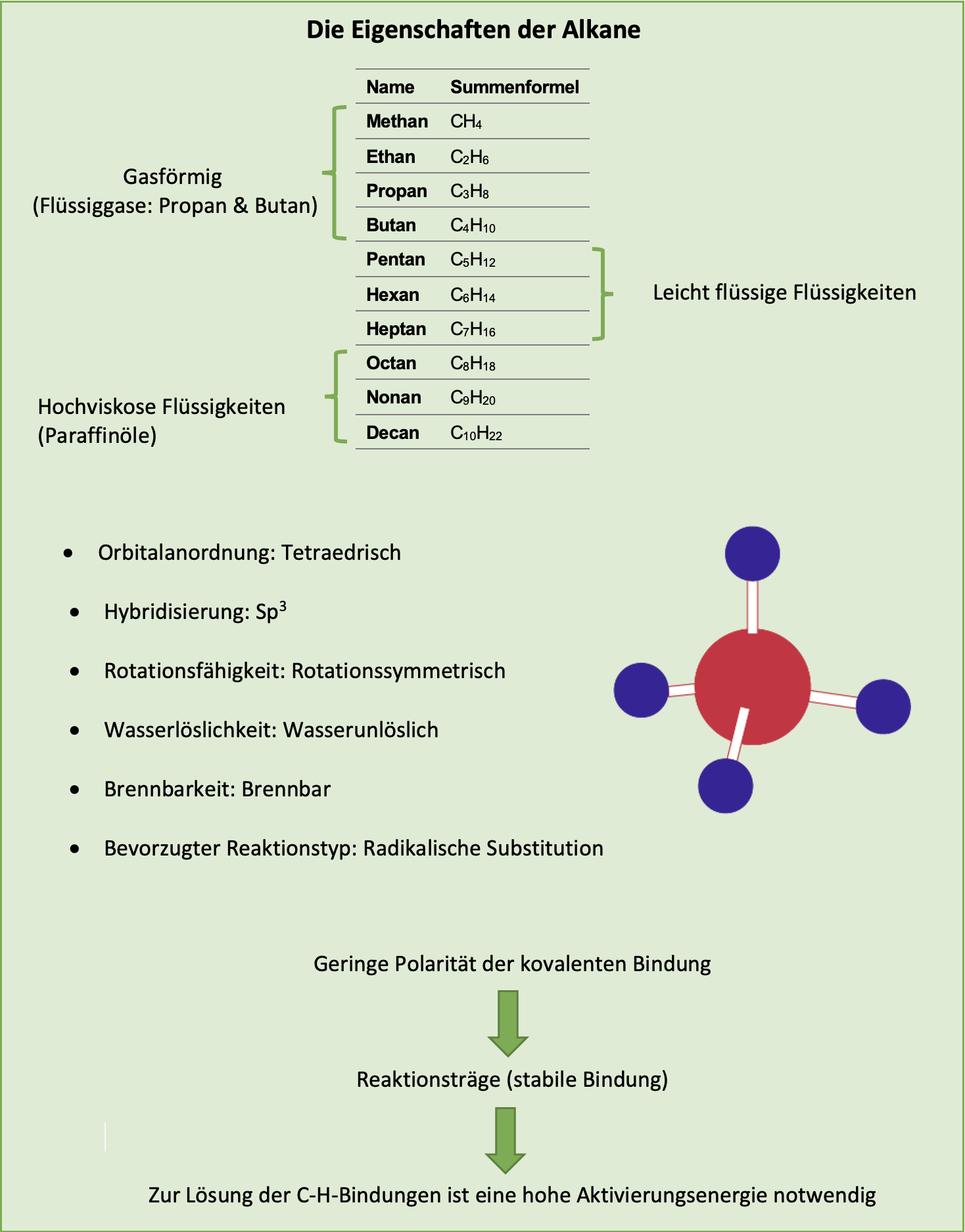
Alkane – Eigenschaften
Um die Eigenschaften der Alkane in einem Blick zu behalten hilft dir folgender Merkkasten:
Reaktionen mit Alkanen
Alkane sind wenig reaktionsfreudig. Nur unter bestimmten Bedingungen gehen sie eine Reaktion ein.
Verbrennung
Alkane sind brennbar und sind somit in der Lage mit Sauerstoff zu reagieren.
Vollständige Verbrennung
Bei der vollständigen Verbrennung handelt es sich um eine Redoxreaktion mit ausreichend Sauerstoff. Aus Methan und Sauerstoff entstehen Kohlenstoffdioxid und Wasser.
CH4 + 2O2 –> CO2 + 2H2O
Unvollständige Verbrennung
Bei der unvollständigen Verbrennung handelt es sich um eine Redoxreaktion mit unzureichendem Sauerstoff. Auch hier entstehen Kohlenstoffdioxid und Wasser.
CH4 + 2O2 –> CO2 + 2H2O
Radikalische Substitution
Bei der radikalischen Substitution handelt es sich um eine Reaktion mit Halogenen (Flour, brom, Chlor, …). Als Aktivierungsenergie wird häufig UV Licht genutzt. Durch Spaltung des Halogenmoleküls in zwei Halogenradikalen (reaktiv) wird im Laufe der Reaktion ein Wasserstoffatom durch ein Halogenatom ersetzt. Es entsteht ein Halogenalkan.
CH4 + Br2 –> CH3Br + HBr
Alkane – Wo kommende vor?
Alkane findet man unteranderem in Heiz- und Brennstoffen (Bio- und Erdgas) wieder. Auch in unserem Sonnensystem lassen sich Spuren von Alkanen wiederfinden. Sogar Lebewesen enthalten Alkane.
Diese Artikel könnten dich auch interessieren:
Wie hat dir unser Artikel gefallen?
Lass uns gerne einen Kommentar dar und erzähl uns, ob dir der Artikel helfen konnte!
Sehr hilfreich!
Euer Beispiel “3-ethylheptan” ist leider nur ein “3-ethylhexan”!
Hallo,
da hast du natürlich recht!
Danke für den Hinweis. Wir haben es korrigiert.
Diggah hat mir Chemie gerettet. Ehhhhhhre
Die unvollständige Verbrennungsformel ist fehlerhaft dargestellt. Woher kommen plötzlich die 2 fehlenden O-Atome auf der rechten Seite ???
Haben wir korrigiert, vielen Dank!