Vielleicht hast du schon mal von den Hauptgruppen des Periodensystems gehört. Denn die Alkalimetalle sind eine dieser Hauptgruppen.
Doch wie genau unterscheiden sich die Alkalimetalle von den anderen Hauptgruppen? Welche Eigenschaften besitzt diese Hauptgruppe?
Wir zeigen dir, was du alles über die Alkalimetalle wissen musst – einfach und übersichtlich erklärt. Lass uns direkt beginnen!
Was sind Alkalimetalle?
Die Alkalimetalle findest du in der ersten Spalte des Periodensystems. Sie bilden zusammen die 1. Hauptgruppe. Dabei zählt Wasserstoff nicht zu der Gruppe, auch wenn es sich in der ersten Spalte des PSE befindet.
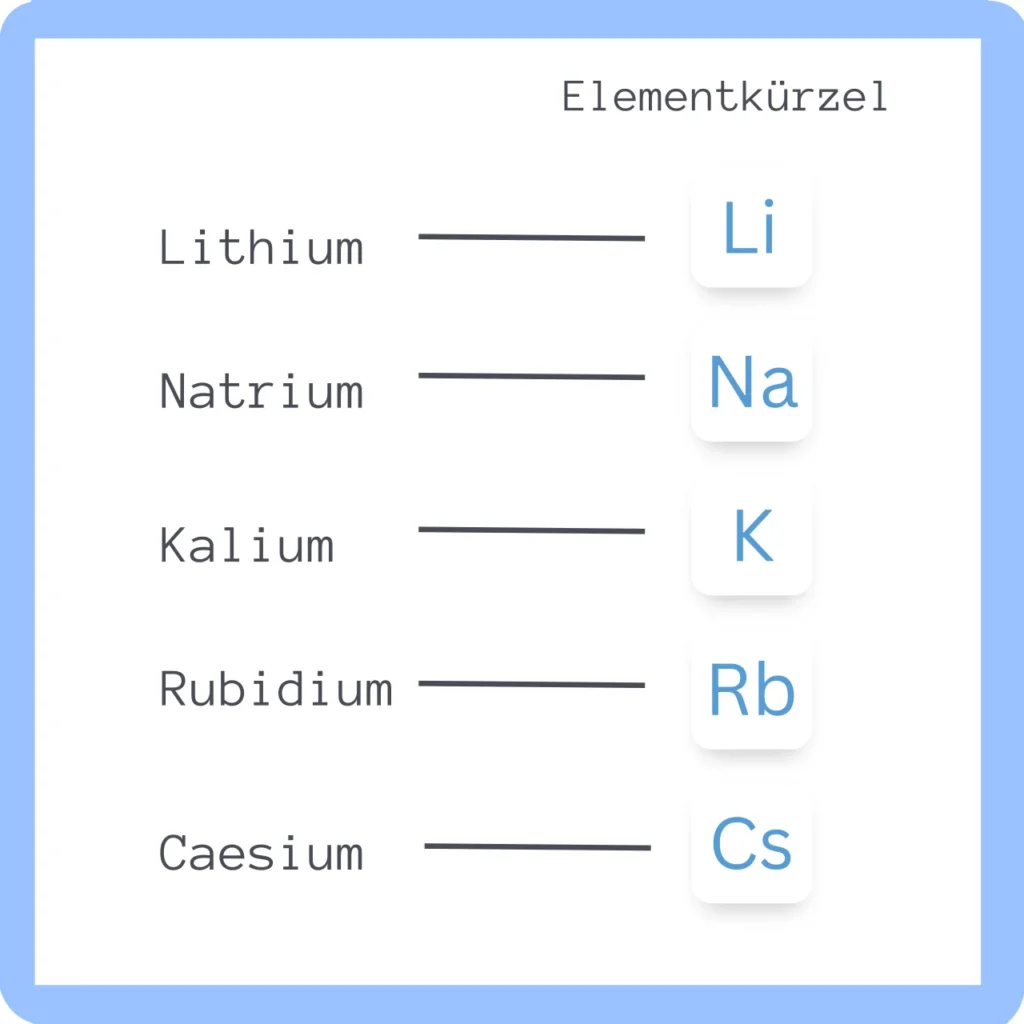
Zu den Alkalimetallen zählen Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Caesium (Cs), und Francium (Fr).
Die Metalle zeichnen sich durch ein silbrig glänzendes Erscheinungsbild aus und dessen Atome besitzen genau ein Außenelektron. Das eine Außenelektron ist auch der Grund, weshalb sie so reaktionsfreudig sind.
Wortursprung
Der Name Alkalimetalle lässt sich auf das arabische Wort ,,al kalja” zurückführen. Das Wort steht für Pottasche, was die frühere Bezeichnung für Kaliumcarbonat war.
Eigenschaften der Alkalimetalle
Die chemischen Elemente der ersten Hauptgruppe nehmen von oben nach unten in den Eigenschaften ab. So haben die Elemente weiter oben einen höheren Schmelz- und Siedepunkt.
Aussehen | silbrig weiß glänzend |
Ordnungszahl | 3 |
Atommasse [u] | 6,94 |
Dichte [g/m³] | 0,534 |
Schmelzpunkt [°C] | 180,54 |
Siedepunkt [°C] | 1330 |
Elektronegativität | 0,98 |

Aussehen | silbrig weiß glänzend |
Ordnungszahl | 11 |
Atommasse [u] | 22,99 |
Dichte [g/m³] | 0,97 |
Schmelzpunkt [°C] | 97,72 |
Siedepunkt [°C] | 890 |
Elektronegativität | 0,93 |

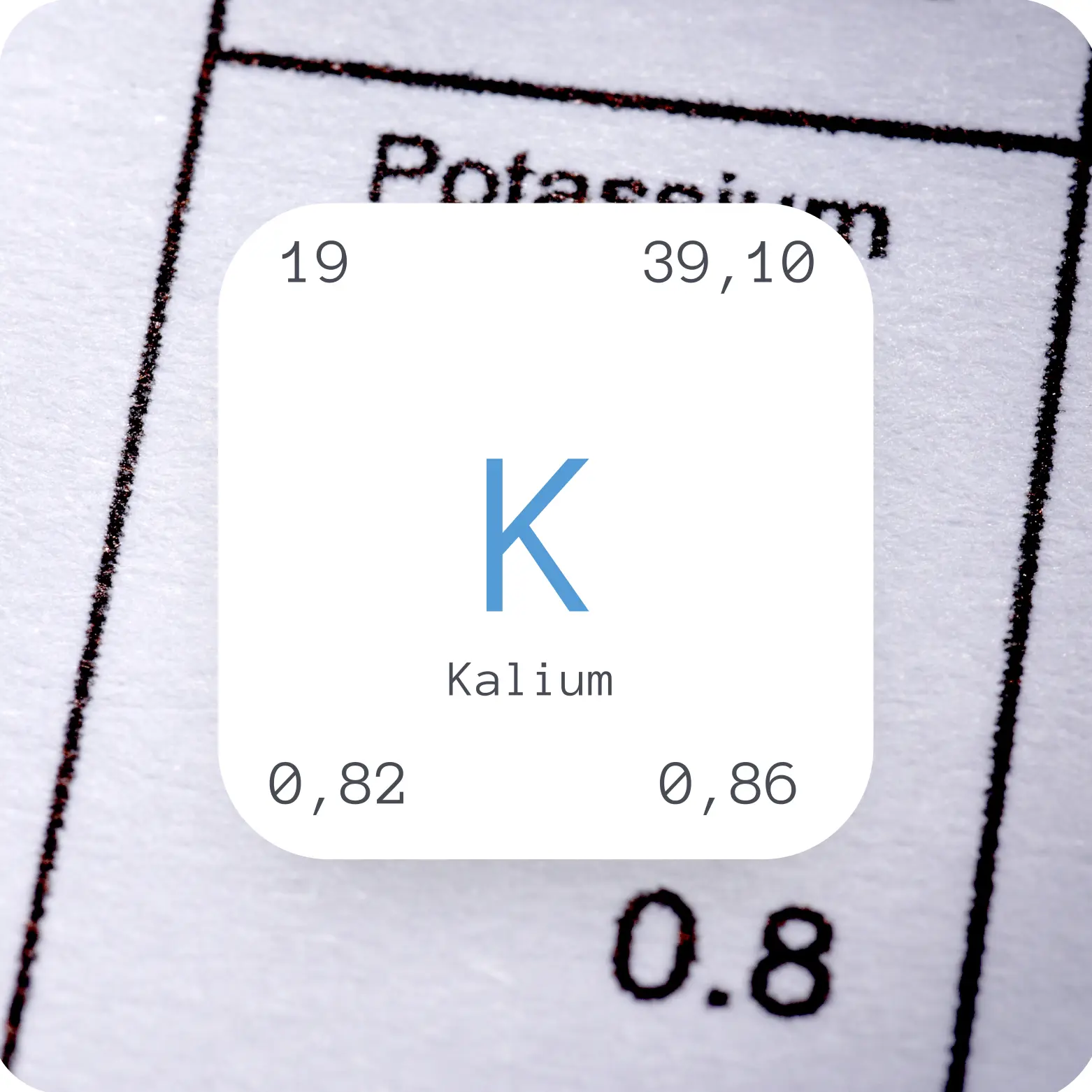
Aussehen | silbrig weiß glänzend |
Ordnungszahl | 19 |
Atommasse [u] | 39,10 |
Dichte [g/m³] | 0,86 |
Schmelzpunkt [°C] | 63,38 |
Siedepunkt [°C] | 774 |
Elektronegativität | 0,82 |
Aussehen | silbrig weiß glänzend |
Ordnungszahl | 37 |
Atommasse [u] | 85,47 |
Dichte [g/m³] | 1,53 |
Schmelzpunkt [°C] | 39,31 |
Siedepunkt [°C] | 688 |
Elektronegativität | 0,82 |

Aussehen | silbrig weiß bis goldgelb glänzend |
Ordnungszahl | 55 |
Atommasse [u] | 132,91 |
Dichte [g/m³] | 1,90 |
Schmelzpunkt [°C] | 28,44 |
Siedepunkt [°C] | 690 |
Elektronegativität | 0,79 |

Aussehen | wshl metallisch aussehend |
Ordnungszahl | 87 |
Atommasse [u] | 223,02 |
Dichte [g/m³] | unbekannt |
Schmelzpunkt [°C] | 25 |
Siedepunkt [°C] | 677 |
Elektronegativität | 0,70 |

Flammenfärbung der Alkalimetalle
Ein weiteres Merkmal der 1. Hauptgruppe ist die Flammenfärbung. Beim Erhitzen der Metalle entstehen unterschiedliche Farben.
Über die Flammenfärbung soll bei chemischen Gemischen identifiziert werden, welche der Alkalimetalle vorhanden ist.
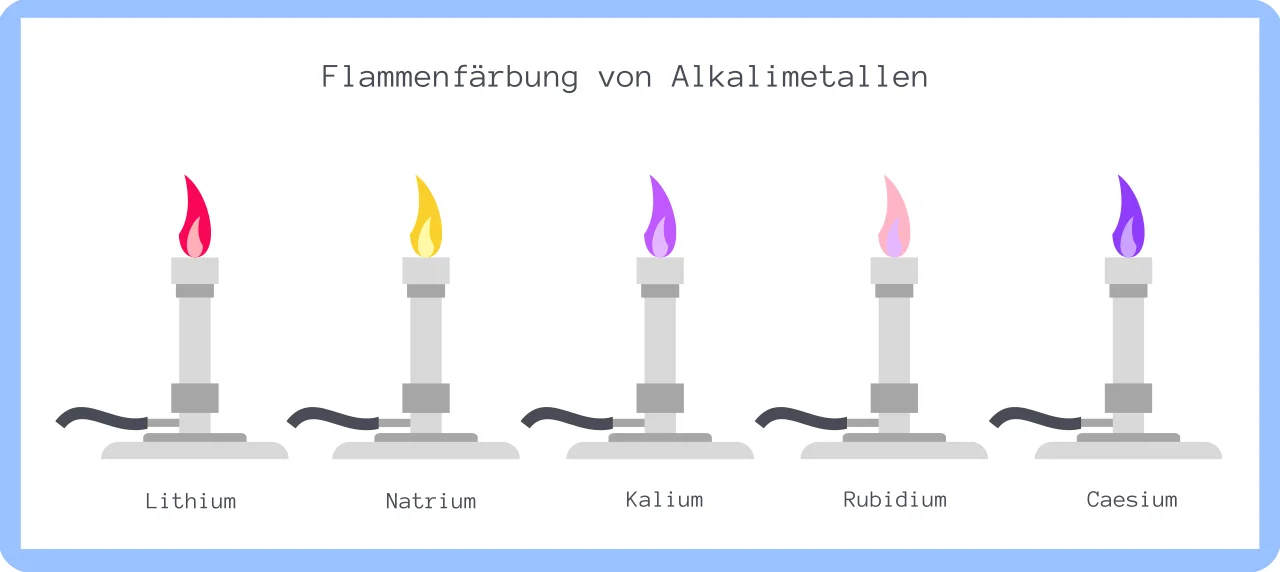
Wie du in der Abbildung sehen kannst, entstehen unterschiedliche Farben. Bei Erhitzung von Lithium rot, Natrium gelb, Kalium violett, Rubidium rotviolett und bei Caesium entsteht eine blauviolette Flammenfärbung.
Viellicht hast du bemerkt, dass die Flammenfärbung von Francium nicht abgebildet ist. Das liegt daran, dass das Alkalimetall sehr instabil ist, reaktionsfreudig und zudem radioaktiv ist. Weshalb dieser Stoff in der Regel von Experimenten etc. ausgeschlossen wird.
Vorkommen Alkalimetallen
Alkalimetalle findest du in der Regel in Form von Mineralien wie zum Beispiel Silicaten. Aber du kannst Natrium auch in Steinsalz oder Ähnlichem finden.
Aufgrund ihrer reaktionsfreudigen Eigenschaft kommen die Elemente der 1. Hauptgruppe nur in chemischen Verbindungen vor und niemals in Reinform.
Zudem befinden sich einige der Metalle (z.B.: Na, K) auch in Form von Ionen im Wasser wieder. Check mal dafür die Inhaltsangabe deiner Wasserflasche und du wirst sehen, dass einige der Metalle in Ionenform sich im Trinkwasser befinden.
Reaktionsverhalten
Wie du oben gelesen hast, sind Alkalimetalle aufgrund ihres Außenelektronen sehr reaktionsfreudig. Wir zeigen dir wie sie mit verschiedenen anderen Elementen reagieren:
Reaktion mit Wasser
Bei der Reaktion mit Wasser (H2O) entstehen ein Alkalimetallhydroxid (AOH) und ein Wasserstoffatom (H2). Hierbei steht A kurz für Alkalimetalle.
Dabei solltest du wissen, dass mit steigender Ordnungszahl auch die Reaktion stärker abläuft. So reagieren zum Beispiel Caesium und Wasser zu einer starken Explosion.
Der entstandene Feststoff löst sich aber mit Wasser und starker Erwärmung wieder auf.
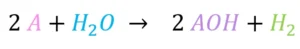
Reaktion mit einem Halogen
Die Halogene bilden die 7. Hauptgruppe des PSE. Auch Elemente dieser Gruppe können mit Alkalimetallen reagieren. Bei der Reaktion entstehen salzartige Alkalimetallhalogenide (AX).
Die entstandenen Alkalisalze lassen sich leicht in Wasser auflösen.
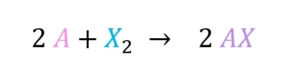
🧪 FAQ – Alkalimetalle 👩🏻🔬
Hier findest du nochmal alle wichtigen Information als FAQ gesammelt.
Was sind Alkalimetalle?
Alkalimetalle findest du im Periodensystem in der 1. Spalte, abzüglich Wasserstoff. Die Metalle bilden die erste Hauptgruppe des PSE.
Lithium – Li
Natrium – Na
Kalium – K
Rubidium – Rb
Caesium – Cs
Francium – Fr
Was ist das besondere bei der Erhitzung von Alkalimetallen?
Bei der Erhitzung von Alkalimetallen entstehen verschiedene Flammenfärbungen:
Li – rot
Na – gelb
K – violett
Rb – rotviolett
Cs – blauviolett
Aufgrund der Flammenfärbung werden diese Elemente in Feuerwerksköpern eingesetzt.
Was entsteht bei der Reaktion mit Wasser bzw. Halogenen?
Alkalimetall + Wasser → Alkalimetallhydroxid und Wasserstoff
Alkalimetall + Halogen → Alkalimetallhalogenid
